纳米孔测序行业研究报告
来源:万原点基金 2022-08-31
1 基因测序
1.1 基本介绍
基因测序技术(DNA sequencing),是指获得目标DNA片段碱基(包括腺嘌呤A、胸腺嘧啶T、胞嘧啶C与鸟嘌呤G)排列顺序的技术。在基础生物学研究,以及包括医学诊断、生物技术开发、法医生物学、系统生物学、微生物学等不断拓展的多个其他应用领域中,基因测序技术已成为极其重要的专业技术之一。现代基因测序技术已经能帮助科学家获得人类基因组以及其他许多动植物和微生物物种的完整DNA序列。
1.2 发展历程
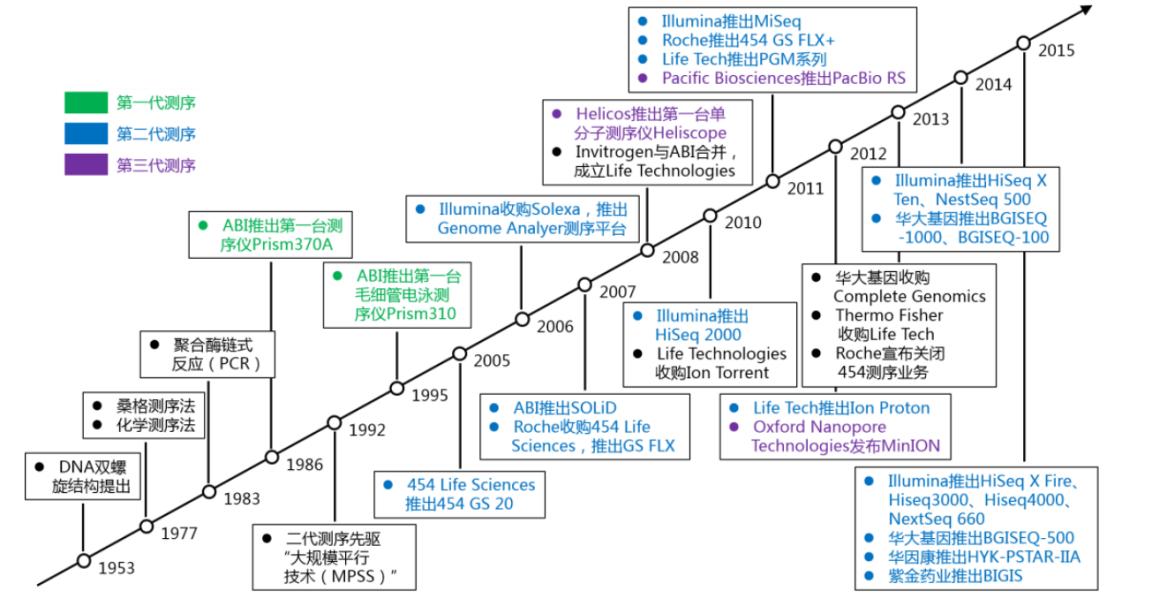
1977年,被后人誉为“基因组学之父”的英国生物化学家弗雷德里克·桑格发明了酶测序法(桑格测序法/ Sanger Sequenceing),并应用于第一个基因组序列的测定:噬菌体X174,全长5375个碱基,标志着基因测序行业的肇始。9年后,ABI公司基二桑格测序法推出了世界上第一台商用测序仪,自此测序技术迚入飞速发展的时代。
随着Illumina、Life Tech及华大等NGS测序厂家的大力推广,二代测序目前已经在科研和临床领域多个应用场景获得应用。但是二代测序技术目前存在读长短、不便携、成本下降空间有限的劣势,市场呼吁长读长、成本更低和更便携的测序产品。
随着ONT的MinION、GridION以及PromethION等测序仪的上市,以及在病原微生物检测等领域的应用日趋成熟,长读长测序迎来快速发展期。
测序技术发展历程示意图
从三代基因测序技术综合比较来看,一代和二代测序技术目前在科研和临床应用领域较为广泛,二代测序相对优势突出,市场空间最大。一代测序的突出优势是高读长及高准确性,一次读取DNA片段长度可达1000bp,准确性可到到99.99%。然而技术原理的限制下高读长的特点反而增加了测序成本,并且测序的通量大打折扣,这就限制了一代测序的应用范围。与之相比,二代基因测序的核心提升在于牺牲了读长的前提下极大优化了成本和通量。采用大规模平行测序原理,不仅极大的降低了测序成本,同时在保证了准确性的前提下实现了高通量测序。第三代基因测序读长较长,如Pacific Biosciences公司的PACBIORS II的平均读长达到10kb,可以减少生物信息学中的拼接成本,且从作用原理上避免了PCR扩增带来的出错,但是总体上单读长的错误率依然偏高,成为限制其商业应用开展的重要原因,同时其分析软件也不够丰富,在成本和通量上也没有比较优势,短期内很难对二代测序形成替代。
1.3 测序技术介绍
1.3.1一代测序技术
1977年,Walter Gilbert和Frederick Sanger发明了第一代测序技术,并应用该测序技术测定了首个基因组序列:全长5375个碱基的噬菌体X174。Walter Gilbert和Frederick Sanger所使用的测序方法是双脱氧链终止法(Chain Terminat Method),也被称为桑格测序法(Sanger测序)。桑格测序法是第一代测序技术的典型代表,是基于DNA聚合酶的DNA合成反应。核苷酸是DNA合成的基本原料。人们对核苷酸迚行改造,使它们具有特殊的功能:(1)用4种荧先基团分别标记4种核苷酸,从而仪器能通过荧先基因检测到核苷酸并区分核苷酸的种类;(2)改造的核苷酸一旦参与DNA的合成就会终止DNA继续合成,将少量改造的核苷酸掺入正常的反应体系中,最终会产生长短不一的DNA片段。基于这个原理,桑格测序法可分为DNA合成和电泳检测两大步骤,对完成DNA合成反应的样品进行毛细管电泳,并利用激先自动读取仪读取测序结果,转换成DNA碱基序列。
Sanger测序原理示意图
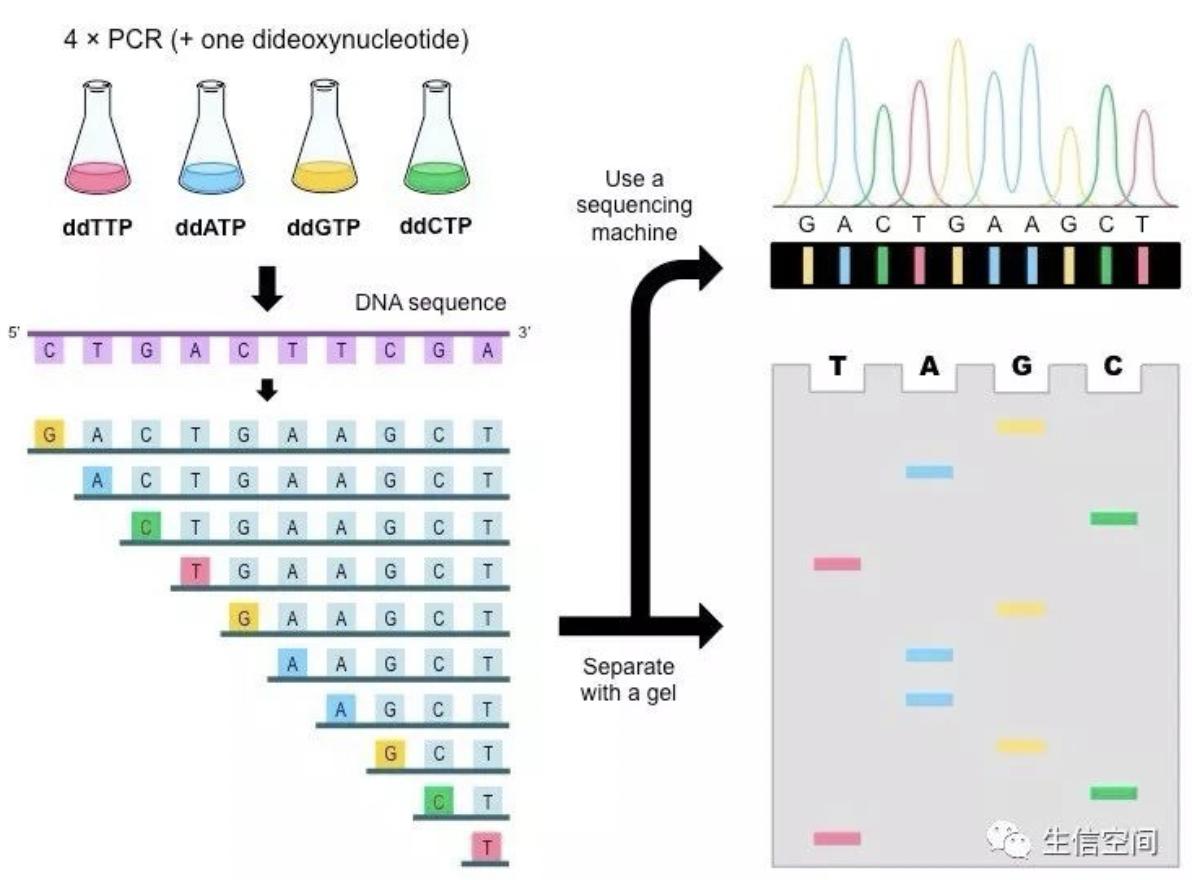
资料来源:Nature Review Genetics,万原点基金整理
1986年,ABI公司首次成功实现第一代测序技术的商业化。经过几十年的发展和推广,目前第一代测序技术已经非常普及,几乎所有的测序公司都会配备第一代测序仪。虽然第一代测序技术这些年来的断完善,但测序基本原理未改发,因此在许多方面仍存在较大限制。
(1)测序通量低:目前第一代测序的速度通常是的80-100Kb/小时,而人类基因组的大小为3Gb左右,因此用第一代测序技术完成整个人类基因组测序的理论时间为3.5年。
(2)测序成本高:由于第一代测序通量较低,均摊刡每个碱基上的测序成本就相应偏高,如美吉测序的终端服务价为15元/Kb。
(3)测序结果存在偏好性:桑格测序法的可避免地需要用的PCR的技术对开始的DNA的进行扩增,而PCR的反应存在偏好性,即高GC的和低GC含量的基因组区域不容易被PCR的扩增,导致在测序过程中测序覆盖度不足,同时对于比例极低的突发基因得扩增效果往往不理想,经过几轮循环反应以后,这些突发的DNA很可能就淹没在噪音里了。然而,这些基因突变却是对人们理解和治疗疾病最有意义的。
1.3.2 二代测序技术
高通量测序技术(High-topsing)是对传统桑格测序技术的革命性改变,可一次对几百万到几十亿条核酸分子进行序列测定,部分文献资料亦称其为下一代测序技术(Next Generation Sequencing, NGS)。高通量测序技术以其通量高、准确性高等优势促进了个人全基因组测序成本从数十万美金降低至数百美金,从而促进基因组学的临床推广。高通量测序技术能有效克服Sanger测序技术成本高、通量低、对人力需求大等缺点,与以往的传统测序技术相比,其从测序原理、测序过程、适用范围及测序结果等方面均存在本质不同。该技术的出现给生物学领域带来新的突破。
NGS测序技术变迁梳理
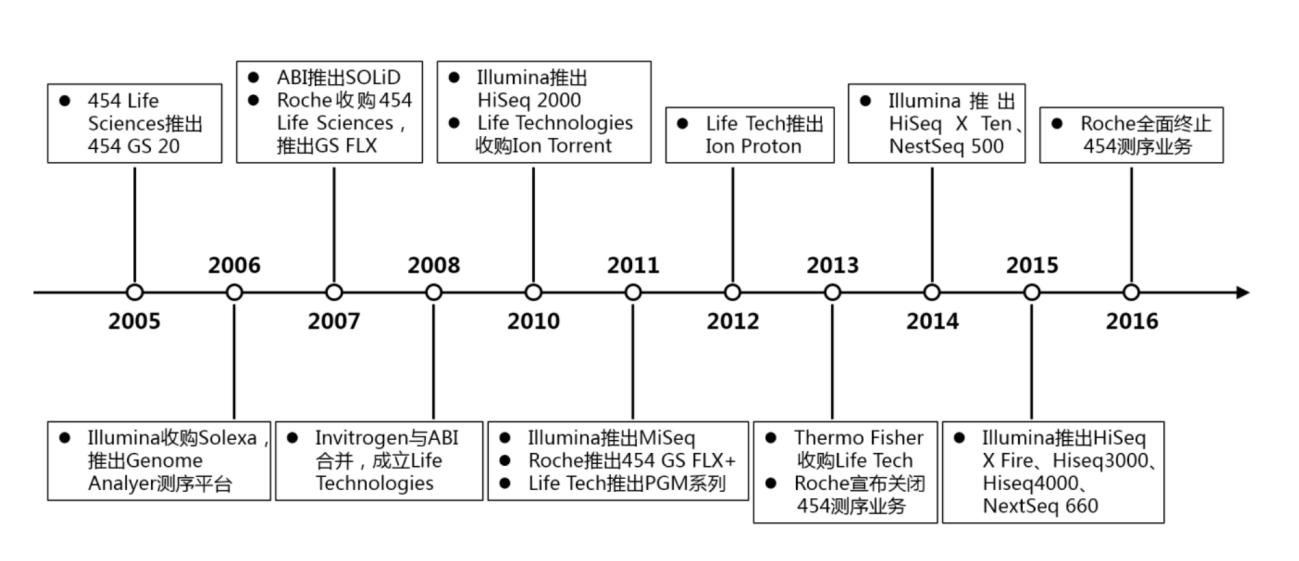
资料来源:Nature Review Genetics,万原点基金整理
NGS主要玩家发展大事件梳理
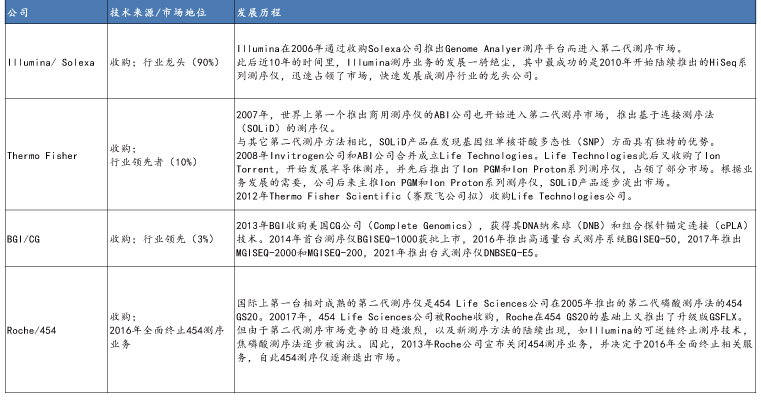 资料来源:公开信息,万原点基金整理
资料来源:公开信息,万原点基金整理
目前高通量测序的主要平台代表有Roche/454公司的焦磷酸测序技术、Illumina/Solexa的可逆末端终止测序技术、Thermo Fisher/Life Tech的SOLiD测序技术、华大智造/ Complete Genomics的DNA纳米球与联合探针锚定聚合技术结合的测序技术。
1.3.2.1焦磷酸测序技术
1996年,Pal Nyren,Mostafa Ronaghi和Mathias Uhlen发明了焦磷酸测序法。454公司首选将焦磷酸测序应用在测序技术上,之后便被罗氏诊断收购,形成了目前的Roche 454。
测序原理:焦磷酸测序技术是由4种酶催化的同一反应体系中的酶级联化学发光反应。焦磷酸测序技术的原理是:引物与模板DNA退火后,在DNA聚合酶(DNA聚合酶)、ATP硫酸化酶(ATP硫化酶)、荧光素酶(1uciferase)和三磷酸腺苷双磷酸酶(Apyrase)4种酶的协同作用下,将引物上每一个dNTP的聚合与一次荧光信号的释放偶联起来,通过检测荧光的释放和强度,达到实时测定DNA序列的目的。焦磷酸测序技术的反应体系由反应底物、待测单链、测序引物和4种酶构成。反应底物为5'-磷酰硫酸(腺苷-5'-磷酸硫酸盐,APS)、荧光素(1uciferin)。
焦磷酸测序原理示意图
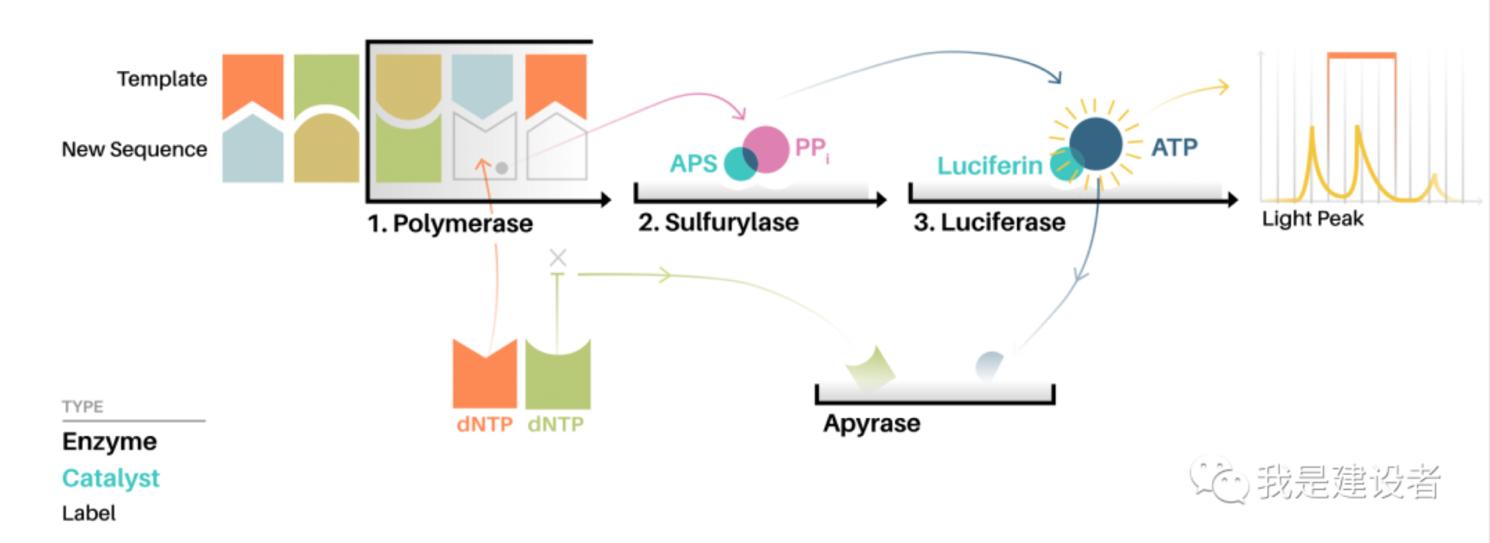
资料来源:公开信息,万原点整理
测序过程:待测DNA样品被打断成300-800bp的片段后,3'和5'端分别加上接头,这些接头会使DNA片段结合到微珠上。测序PCR反应就发生在固相的微珠上,并且整个PCR反应和相关的酶被油包水的液滴包裹,每个油滴系统只包含1个DNA模板。扩增后,每个DNA分子可以得到富集,每个微珠只能形成一个克隆集落。454测序仪的测序通道体积非常狭小,只能容纳一个微珠。测序过程中,GS FLX系统会将引物上dNTP的聚合与荧光信号释放偶联起来。通过检测荧光信号,就可以达到DNA测序的目的。
技术特点:(1)速度快:一个测序反应耗时10个小时,获得4-6亿个碱基对,比传统Sanger测序的方法快100倍;(2)读长长:单个序列读长平均可达450bp左右;(3)准确度高:读长超过400bp时,单一读长准确性可以超过99%;(4)一致性好:测序结果一致性超过99.99%;
技术缺点:无法准确测量同聚物,检测插入缺失突变误差率高;通量低、测序成本高。虽然Roche 454具有读长优势,但是测序通量和成本始终限制了454平台的推广,因此Roche在2016年底终止了454 NGS测序相关的业务。
1.3.2.2 可逆末端终止测序技术
Solexa的测序原理是可逆终止化学反应。DNA片段加上接头之后,可以随机的附着于玻璃表面(Flow cell),并且在固相的表面经过桥式扩增。这样就形成了数千份相同的单分子簇,被用做测序模板。测序采取边合成边测序的方法,和模板配对的ddNTP原料被添加上去,不配对的ddNTP原料被洗去,成像系统能够捕捉荧光标记的核苷酸。随着DNA 3'端的阻断剂的去除,下一轮的延伸就可以进行。和焦磷酸测序不同,每次DNA的只能延伸一个核苷酸。Solexa的读长在100-150bp之间,适合小RNA鉴定、甲基化和表观遗传学研究。
可逆末端终止测序原理示意图
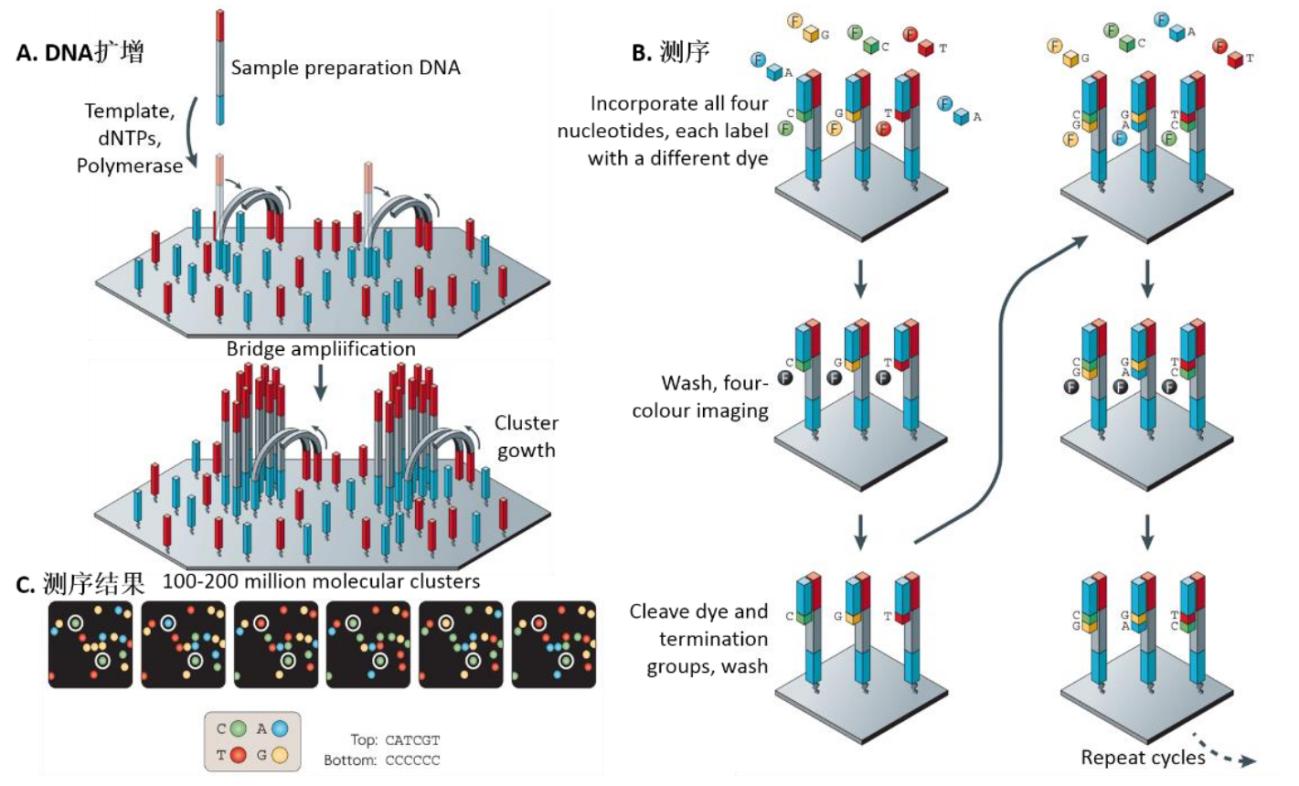
资料来源:Nature Review Genetics,万原点基金整理
测序步骤:
(1)桥连PCR扩增DNA:在芯片表面附着许多测序用的引物,待测序的DNA能与这些引物特异性地结合,从而被固定到芯片上,再通过PCR反应,大量增加DNA的数量。
(2)可逆链终止法测序:该测序方法通过4种特殊修饰的核苷酸来实现。与第一代测序相似,A、T、C、G这4种核苷酸分别带上不同的荧先基团标记,能够被识别和区分。同时,它们的结合能使DNA合成暂停。通过激先照射,这些核苷酸的化学结构发生改发,荧先基团被切除,并且不再具有中断DNA合成的特性,使DNA合成能继续进行。简单地说,测序的过程是“核苷酸掺入DNA新链合成”、“洗脱多余核苷酸”、“激先照射读取信号”三个步骤的不断很环。
(3)测序结果分析:对二某一条固定在芯片上的DNA片段,每迚行一个很环的测序反应,该DNA片段所在位置对应的探头就能读取到一个荧先信号。随着测序反应的进行,将得到一系列的信号,再把这些荧先信号对应回相应的核苷酸,即得到该DNA片段的碱基序列。然后把每个位置的DNA片段的序列进行拼接,就能还原出初始DNA的完整序列。但由于在DNA扩增阶段,并非DNA文库中所有的DNA都能顺利结合到芯片上,因此实际操作中通常会进行多次测序反应,再把各次的测序结果进行汇总拼接,提高DNA文库的覆盖度。
1.3.2.3 SOLID测序技术
Solid测序技术是ABI公司于2007年开始投入用于商业测序应用的仪器。它基于连接酶法,即利用DNA连接酶在连接过程之中测序。Solid测序技术的核心是4种荧光标记寡核苷酸的连接反应测序。测序之前,DNA模板通过乳化PCR扩增,和Roche 454的基本相同,只是Solid的微珠更小,只有1μm。3'端修饰的微珠可以沉淀在玻片上。连接测序所用的底物是8个碱基荧光探针混合物,根据序列的位置,样品DNA就可以被探针标记。DNA连接酶优先连接和模板配对的探针,并引发该位点的荧光信号的产生。Solid的读长只有50-75bp,精确度可达Q40,适于基因组重测序和SNP检测。
Solid测序原理示意图
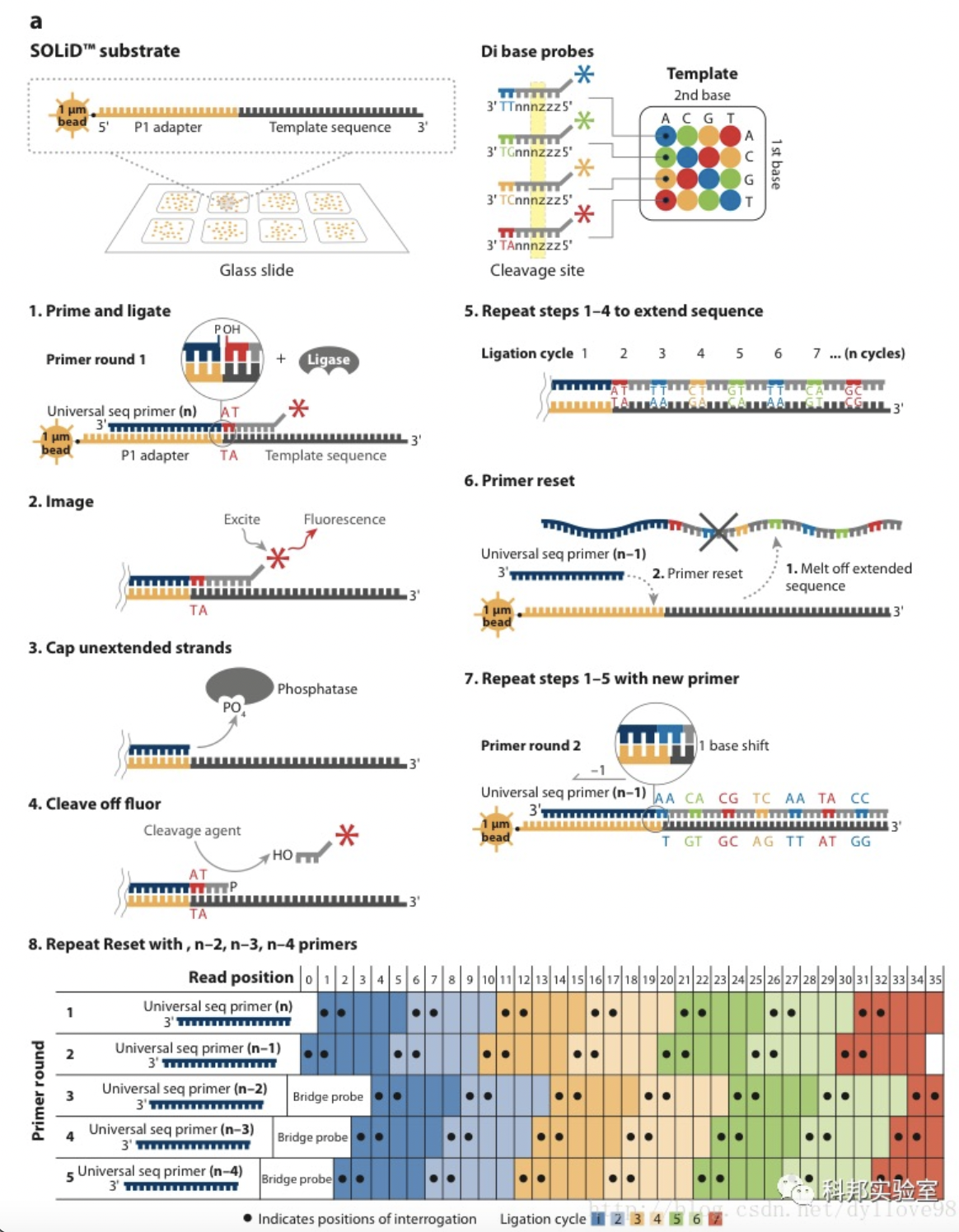
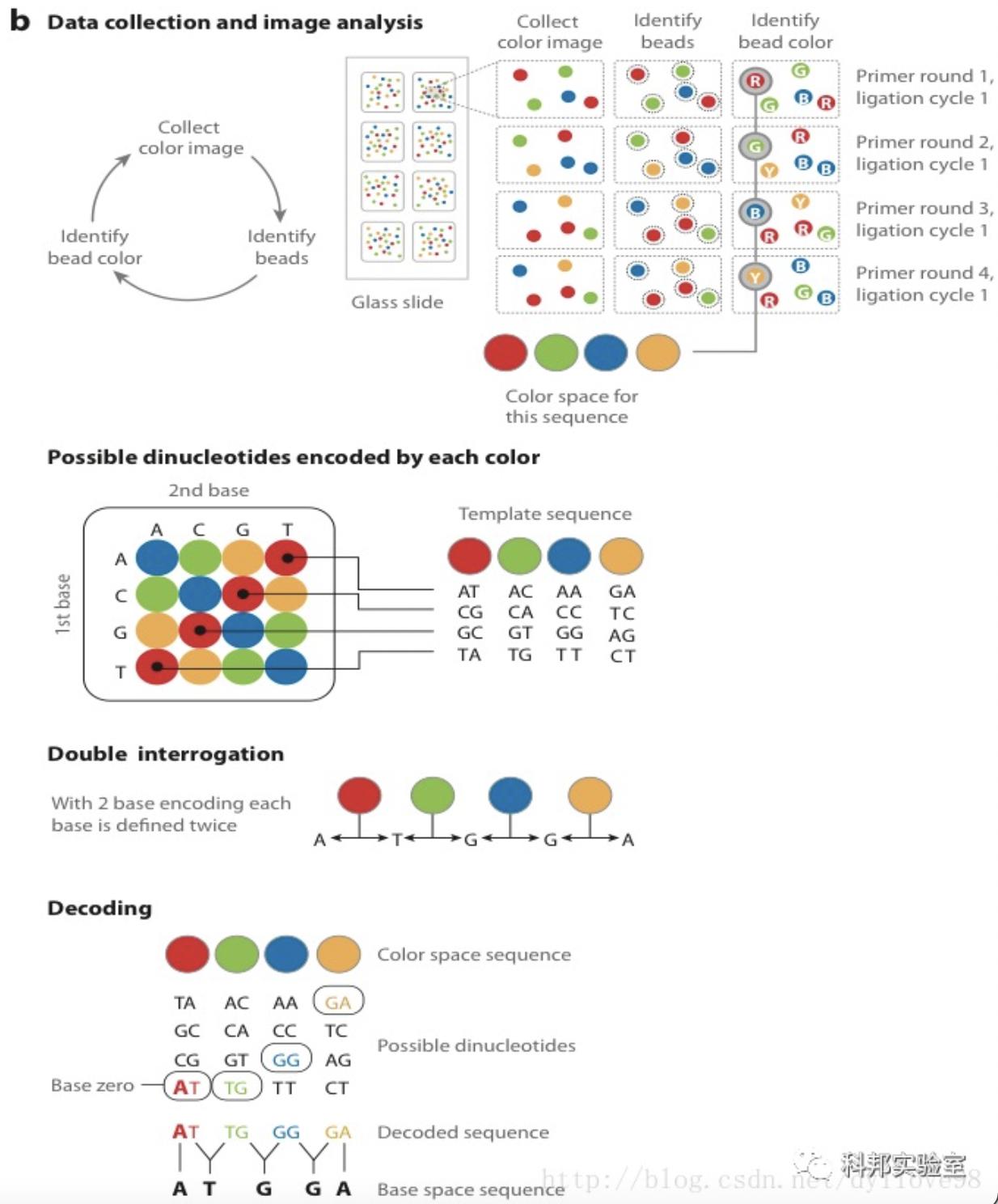
资料来源:公开信息,万原点基金整理
测序步骤:
(1)DNA文库构建:片段打断并在片段两端加上测序接头,连接载体,构建单链DNA文库。
(2)Emulsion PCR:Solid的PCR过程也和454的方法类似,同样采用小水滴emulsion PCR,但这些微珠比起454系统来说则要小得多,只有1um。在扩增的同时对扩增产物的3’端进行修饰,这是为下一步的测序过程作的准备。3’修饰的微珠会被沉积在一块玻片上。在微珠上样的过程中,沉积小室将每张玻片分成1个、4个或8个测序区域。Solid系统最大的优点就是每张玻片能容纳比454更高密度的微珠,在同一系统中轻松实现更高的通量。
(3)连接酶测序:这一步是Solid测序的独特之处。它并没有采用以前测序时所常用的DNA聚合酶,而是采用了连接酶。Solid连接反应的底物是8碱基单链荧光探针混合物,这里将其简单表示为:3’-XXnnnzzz-5’。连接反应中,这些探针按照碱基互补规则与单链DNA模板链配对。探针的5’末端分别标记了CY5、Texas Red、CY3、6-FAM这4种颜色的荧光染料。这个8碱基单链荧光探针中,第1和第2位碱基(XX)上的碱基是确定的,并根据种类的不同在6-8位(zzz)上加上了不同的荧光标记。这是Solid的独特测序法,两个碱基确定一个荧光信号,相当于一次能决定两个碱基。这种测序方法也称之为两碱基测序法。当荧光探针能够与DNA模板链配对而连接上时,就会发出代表第1,2位碱基的荧光信号,图的比色版所表示的是第1,2位碱基的不同组合与荧光颜色的关系。在记录下荧光信号后,通过化学方法在第5和第6位碱基之间进行切割,这样就能移除荧光信号,以便进行下一个位置的测序。不过值得注意的是,通过这种测序方法,每次测序的位置都相差5位。即第一次是第1、2位,第二次是第6、7位……在测到末尾后,要将新合成的链变性,洗脱。接着用引物n-1进行第二轮测序。引物n-1与引物n的区别是,二者在与接头配对的位置上相差一个碱基。也即是,通过引物n-1在引物n的基础上将测序位置往3’端移动一个碱基位置,因而就能测定第0、1位和第5、6位……第二轮测序完成,依此类推,直至第五轮测序,最终可以完成所有位置的碱基测序,并且每个位置的碱基均被检测了两次。该技术的读长在2×50bp,后续序列拼接同样比较复杂。由于双次检测,这一技术的原始测序准确性高达99.94%,而15x覆盖率时的准确性更是达到了99.999%,应该说是目前第二代测序技术中准确性最高的了。但在荧光解码阶段,鉴于其是双碱基确定一个荧光信号,因而一旦发生错误就容易产生连锁的解码错误。
1.3.2.4 联合探针锚定聚合测序技术
BGI测序平台源于美国CG公司(Complete Genomics)的DNA纳米球(DNB)和组合探针锚定连接(cPLA)技术,华大在2013年3月18日正式收购CG公司,获得其测序技术平台。其测序原理与Ilumina类似,只是测序单元“簇”由DNB替代,DNB的制备采用滚环扩增技术(RCA),该技术始终以原始模板为模板进行扩增,因此扩增错误不会像桥式PCR一样会被累积呈指数放大,进而增加了测序的准确性。
测序步骤:
基因组DNA首先经过片段化处理,再加上接头序列,并环化形成单链环状DNA,随后使用的滚环扩增技术(Rolling circle amplification, RCA)可将单链环状DNA扩增2-3个数量级,所产生的扩增产物称为DNA纳米球(DNA nanoball, DNB),最终纳米球经过DNB装载技术固定在阵列化的硅芯片上。
Pattern array技术:华大基因测序芯片的规则阵列(Pattern Array)采用先进的光刻和干法刻蚀技术,在硅片表面形成阵列和对准标记,通过“涂敷深紫外光刻胶--阵列图案曝光—显影暴露局部硅表面—汽相沉积(氨基硅烷修饰)”系列处理,来实现DNA纳米球的固定。硅片最后被分切成25mmX 75mm的小片,成为测序芯片的基底。
cPAS技术(优化的联合探针锚定聚合技术):首先DNA分子锚和荧光探针在DNB上进行聚合,随后高分辨率成像系统对光信号进行采集,光信号经过数字化处理后即可获得待测序列。生化反应时间缩短到60秒完成。通过Sub-pixelRegistration算法,大大提高了碱基识别的准确度;并通过Multi-threadparallel compression算法以及对执行效率的优化,实现了图像处理和碱基识别的实时化。
最后数据的收集与分析。根据需求,完成不同的测序应用。
联合探针锚定聚合测序原理示意图
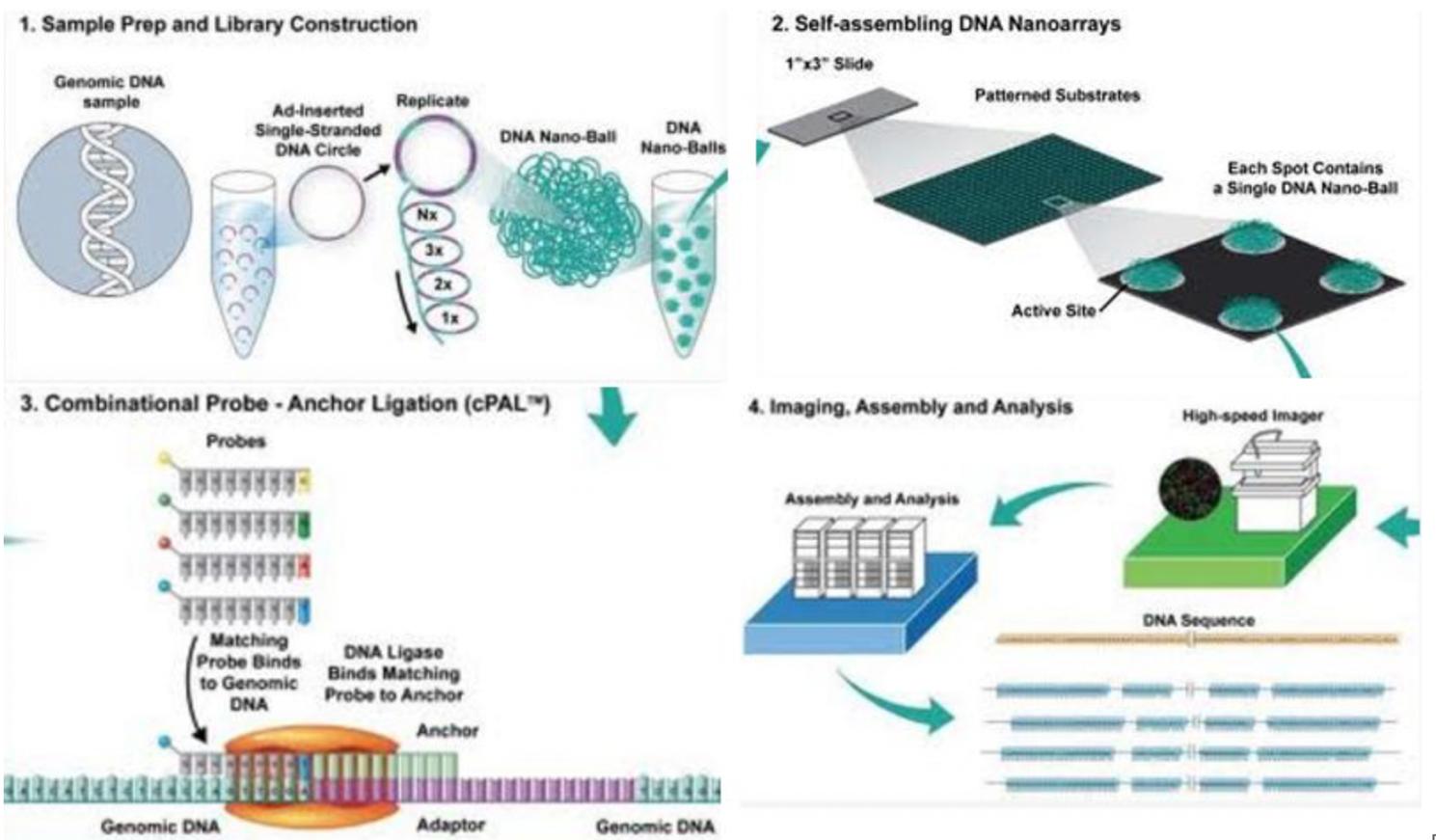
技术特点:
(1)高准确性:PCR-free DNB使用的滚环扩增技术,使得扩增模板始终不变,扩增错误不会累积,与PCR指数扩增相比有保真优势,在进行Indel检测上具有显著性优势。
低Adapter Rate:BGISEQ/MGISEQ测序仪采用单链环化DNA文库,其制备过程中残留的接头由于没有环化而被消化掉,使得华大智造测序平台有着超低的adapter rate,一般情况下低于0.5%。
(2)低Duplicate Rate:基于纳米球测序技术的BGISEQ/MGISEQ系列芯片上的活化位点与DNB纳米球的大小一致,使芯片位点只能结合一个DNB纳米球。因此,BGISEQ/MGISEQ测序仪产出duplicate rate只在3%以下。
(3)“0” Index Hopping:华大智造测序平台独特的文库构建技术和单链环状文库滚环扩增技术使得index hopping发生概率远低于其他测序平台,仅采用单barcode就可将index hopping发生概率控制在0.0001%~0.0004%。
1.3.3 三代测序技术
除Sanger测序技术与高通量测序技术之外,单分子测序技术亦为一种测序选择,该技术的特点是无需对DNA模板进行扩增。最初单分子测序技术采用与Sanger测序技术类似的荧光测序法。之后单分子荧光测序法由Pacific Biosciences的单分子实时测序(Single-molecule Real-time Sequencing, SMRT)技术平台继续发展。除荧光测序法外,纳米孔技术也是一种单分子测序的方向,目前相对成熟的单分子纳米孔测序仪来自Oxford Nanopore。虽然单分子测序技术相较于高通量测序技术的读长更长,但是其单个碱基错误率在1~10%左右,高于高通量测序技术。
Sanger测序技术、高通量测序技术和单分子测序技术在成本、读长、通量和准确率等指标上具有不同的优劣势。高通量测序技术通量高,在大幅降低了测序成本的同时又保持了较高的准确性。Sanger测序技术与高通量测序技术相比,虽然读长较长、准确率较高,但是有着成本较高、通量较低的缺点。单分子测序技术与高通量测序技术相比,虽然读长较长,但是成本与准确率无法同时达到相近水平。因此,高通量测序技术是目前基因测序技术大规模商业化应用普及的主要推动力,在较长时间内仍将保持主流测序技术的地位。
第三代测序技术是测序行业新的里程碑,主要以PacBio公司的SMRT技术和Oxford Nanopore Technologies(ONT)公司的纳米孔单分子测序技术为代表。与前两代相比,他们最大的特点就是单分子测序,即测序过程无需进行PCR扩增。
1.3.3.1 单分子荧光测序技术
PacBio公司的SMRT技术应用了边合成边测序的思想,并以SMRT芯片为测序载体。其基本原理是:首先利用聚合酶捕获文库DNA序列并锚定在零模波导孔底部;之后在碱基配对阶段,4种不同荧光标记的dNTP会随机进入零模波导孔底部并与DNA模板的碱基匹配,在酶的作用下合成碱基并发出不同荧光信号,根据荧光的波长与峰值即可判断进入的碱基类型进而获得DNA序列。SMRT技术将荧光染料标记在核苷酸的磷酸链而不是碱基上,当核苷酸掺入到新生的链中,标记基团就会自动脱落,减少了DNA合成的空间位阻,维持DNA链连续合成,延长了测序读长。DNA聚合酶是实现超长读长的关键之一,读长主要跟酶的活性保持有关,它主要受激光对其造成的损伤所影响,SMRT测序最大限度地保持了聚合酶的活性,是最接近天然状态的聚合酶反应体系。
此外,SMRT技术的另一个关键是怎样将反应信号与周围游离碱基的强大荧光背景区分出来。他们利用的是纳米级的零模波导孔(ZMW),每个ZMW都能够包含一个DNA聚合酶和一条DNA样品链进行单分子测序,并实时检测插入碱基的荧光信号。ZMW是一个直径只有10~50nm的小孔,小孔的直径很有考究,如果直径大于微波波长,能量就会在衍射效应的作用下穿透面板而泄露出来,从而与周围小孔相互干扰;如果孔径小于波长,能量不会辐射到周围区域,而是保持直线状态(光衍射的原理),从而起到保护作用。在一个反应管(SMRT Cell:单分子实时反应孔)中有许多这样的圆形纳米孔,即ZMW,其外径比检测激光波长小(数百纳米),当激光打在ZMW底部时并不能穿透小孔进入上方溶液区,能量被限制在一个小范围里,正好足够覆盖需要检测的部分(DNA聚合酶就被固定在这个区域),使得荧光信号仅来自这个小反应区域。激光从底部打上去后,孔外过多的游离核苷酸单体依然留在黑暗中,从而实现将背景降到最低。
单分子荧光测序原理示意图
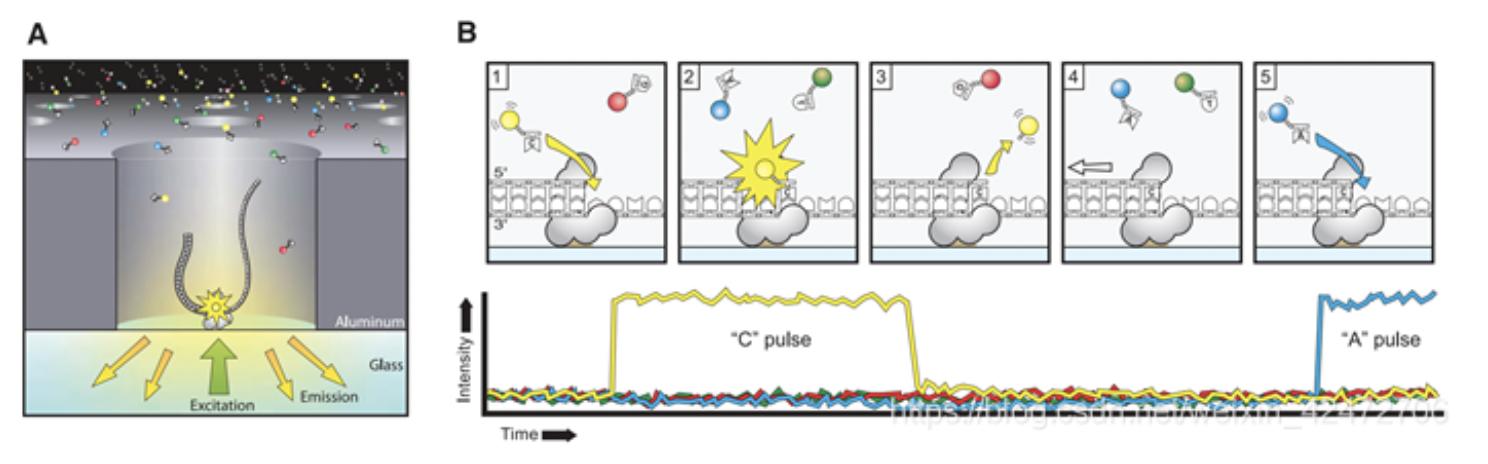
A)DNA模板单链与DNA聚合酶结合并固定在ZMW底部;B)标记的dNTP插入的示意图,以及相对应的从ZMW检测到的荧光强度的预期时间轨迹
另外,还可以通过相邻两个碱基之间的测序时间,来获得一些碱基的修饰情况,即如果碱基存在修饰,则通过聚合酶时的速度会减慢,相邻两峰之间的距离会增大,以此来获得甲基化等信息。SMRT技术的测序速度很快,每秒可测约10个dNTP。但是其测序错误率较高(这几乎是目前单分子测序技术的通病),达到15%。与第二代测序技术存在有偏向的测序错误不同的是,第三代测序的测序错误是随机的,可以通过多次测序来进行有效的纠错,但相应的多次测序的成本也会有所增加。
1.3.3.2 纳米孔测序技术
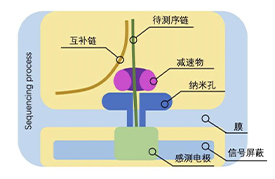
纳米孔测序是将人工合成的一种多聚合物的膜浸在离子溶液中,多聚合物膜上布满了经改造的穿膜孔的跨膜通道蛋白(纳米孔),也就是Reader蛋白在膜两侧施加不同的电压产生电压差,可使DNA链在马达蛋白的牵引下,解螺旋通过纳米孔蛋白。因为不同碱基本身带有不同电荷,因此不同碱基通过纳米孔的时候会形成特征性离子电流变化信号,也就是将化学碱基序列转换为电信号,通过捕获电流变化来识别碱基序列。
纳米孔测序原理示意图
图中的跨膜的蛋白质(reader)形成一个nanopore,孔径刚好可以穿过一个核苷酸。上方有马达蛋白来实现对核酸分子的减速过程。膜的电阻率很高几乎不导电,所以电流只能从pore通过,膜两侧是含有离子的溶液,加上电压后,不同的碱基穿过reader导致nanopore不同程度的堵塞,从而收集到电流信号。
Nanopore测序收集到电信号示意图
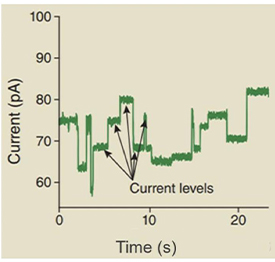
纳米孔测序的主要特点是:读长很长,大约在几十kb,甚至上百kb;错误率目前介于1%至4%,且都是随机错误,不会聚集在读取的两端;其数据可实时读取; 通量很高(30X人类基因组有望在一天内完成);起始DNA在测序过程中不会被破坏;样品制备十分简单且廉价。理论上讲,纳米孔也能直接对RNA进行测序。此外,纳米孔单分子测序还能够直接读取出甲基化的胞嘧啶,不必像传统方法那样对基因组进行bisulfite处理。这对于在基因组水平直接研究表观遗传相关现象有极大的帮助。
纳米孔测序方案中有一个至关重要的问题是需要解决检测器的灵敏度问题,单个核苷酸分子足够小,即便是在100~200mV的电压作用下,核酸链通过纳米孔的速度仍然非常快,如何通过检测器检测到单个的核苷酸分子信息是摆在工程师面前的一大难题。Oxford Nanopore Technologies通过在待测序链中加入一个“马达蛋白”来实现对核酸分子的减速过程,且核酸链通过纳米孔后仍可保持完整。纳米孔测序方法的创始人Bayley采用的方式是在纳米孔上方加入一个核酸外切酶,或是在测序溶液中加入核酸外切酶,将核酸链上的碱基逐个剪下,通过对溶血素进行改性,延缓单个核苷酸分子通过纳米孔的时间,来满足检测的时间分辨率要求。纳米孔测序本质上也属于单分子测序。前面已经强调过碱基特别小,还需要精确穿过纳米孔,其技术难度可想而知。
纳米孔测序过程示意图
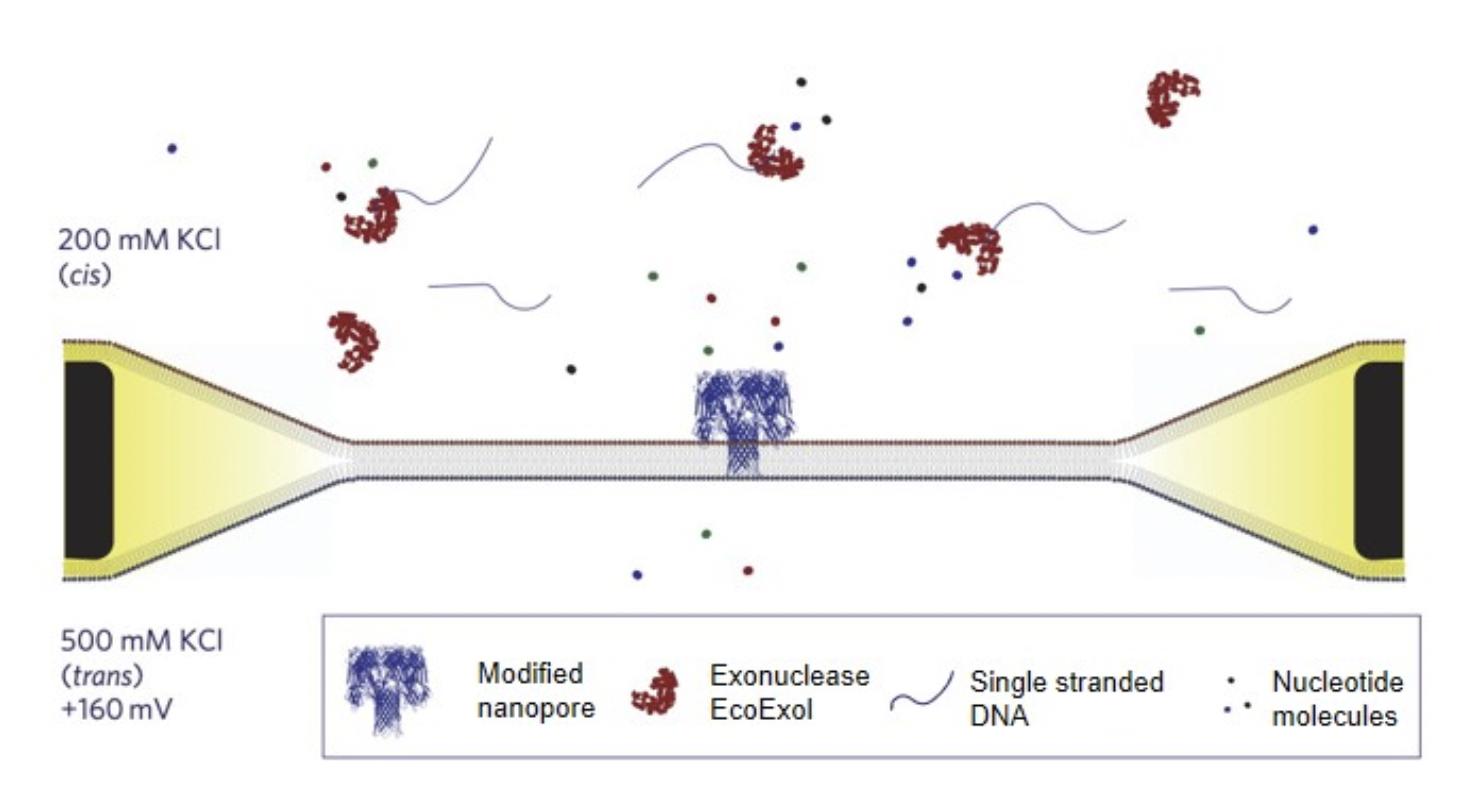
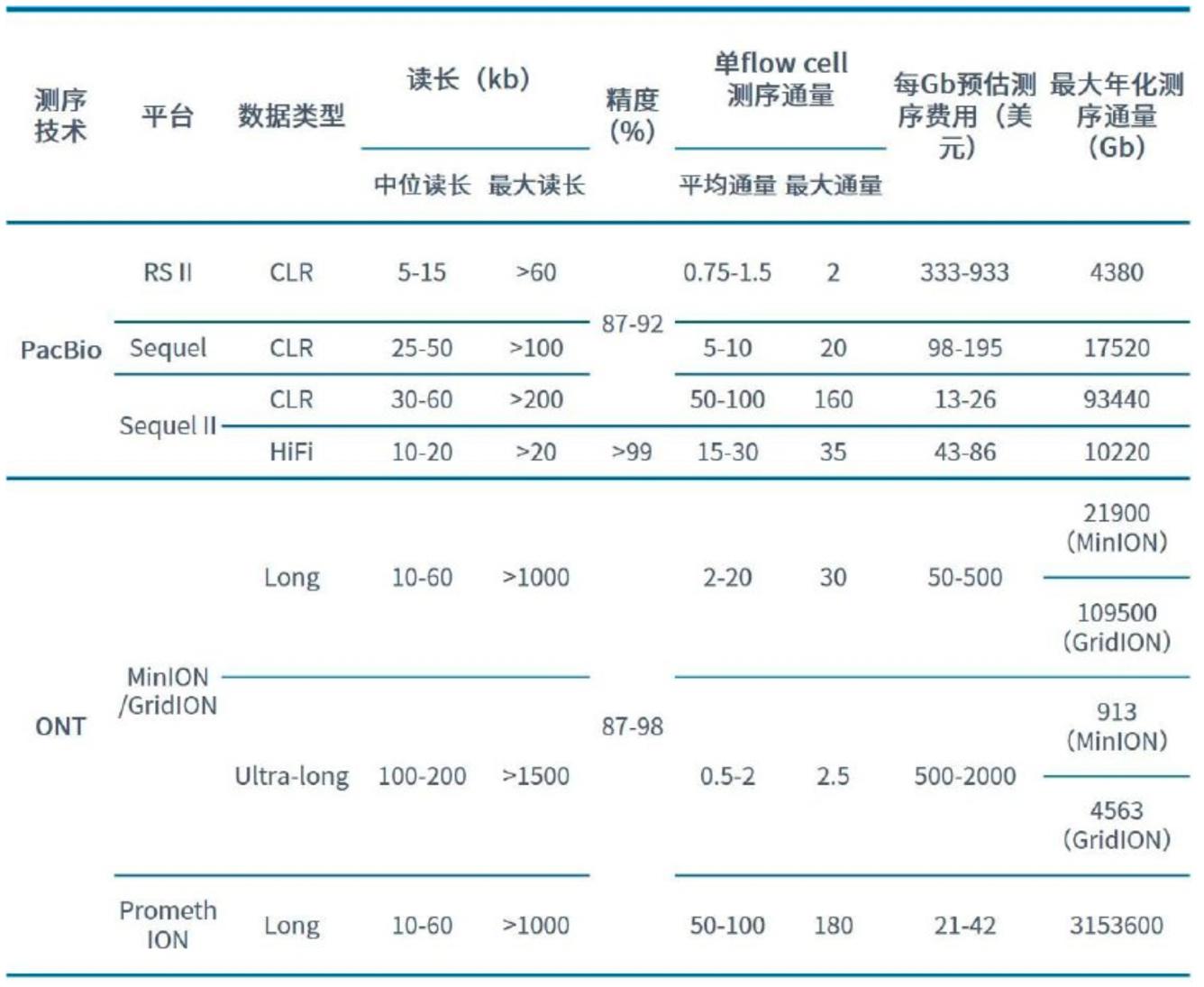
1.3.4 不同测序技术比较
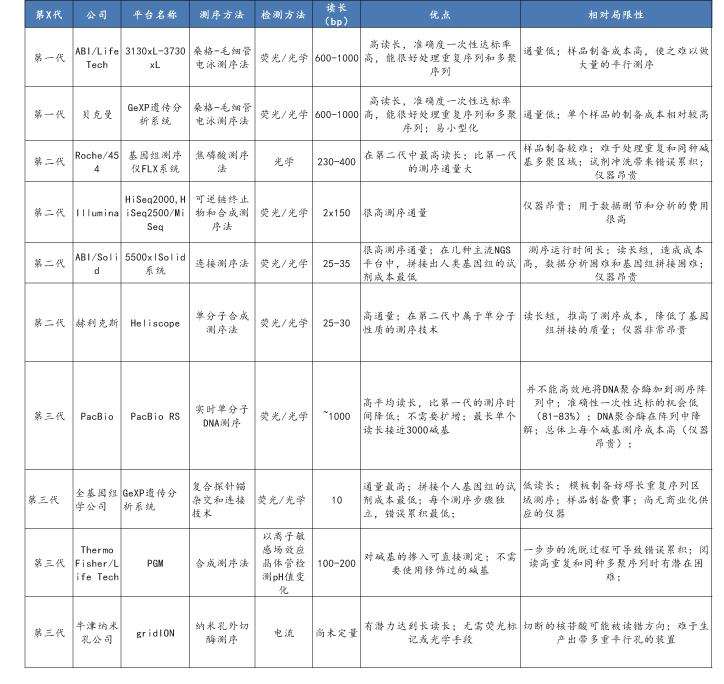
资料来源:公开信息,万原点基金整理
1.4 市场规模
目前主要的测序上游供应商依然以海外为主,各巨头之间的竞争也异常激烈。在1986年Applied Biosystem公司第一台商用自动测序仪的发布吹响了抢占市场份额的号角。在1986年-2005年间,测序仪市场竞争相对缓和,基本由ABI公司占领市场,整体市场份额也相对较小,并未完全打开。2005年,454 Life Sciences公司推出454 GS 20测序仪;2006年,Illumina收购Solexa;2006年,ABI公司推出Solid测序平台。二代测序仪逐步进入市场,迅速抢占市场份额的同时,也进一步提高需求量,扩大整体市场容量。随后的十年间,各大巨头争相并购优秀企业,逐步完善测序技术,产品推陈出新,市场规模被迅速扩大。
根据Markets and Markets的报告以及灼识咨询《全球及中国生命科学综合解决方案行业报告》的数据,在应用场景不断拓宽,测序能力进一步加强的共同促进作用下,全球基因测序仪及耗材市场在过去数年间保持了两位数的增长。预计到2030年,全球基因测序仪及耗材市场将达到245.8亿美元的市场规模,中国基因测序仪及耗材市场将达到303.9亿元的市场规模。
2015-2030年全球测序仪及耗材市场规模
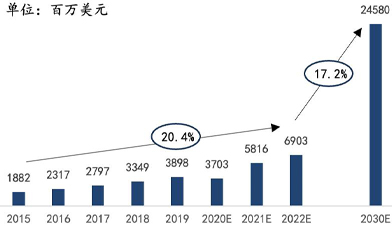
2015-2030年全球测序仪及耗材市场规模
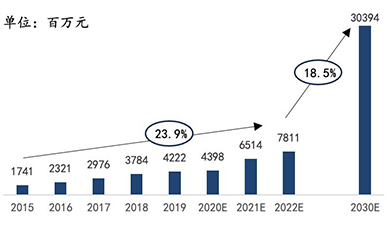
资料来源:Markets and Markets,华大智造招股书,万原点基金整理
二代测序仪具有高通量、低成本、数据稳定可靠等优点,成为测序仪领域的主要贡献者。经过了十年左右的发展成熟,逐渐形成以Illumina公司为领头羊,以Thermo Fisher和Roche为主要玩家的市场格局,由于测序仪技术壁垒极高,市场极度集中,这三家公司合计市场份额超过了95%,其中Illumina公司产品独占鳌头,行业一致认为Illumina占据了全球70-80%的市场份额。目前二代测序以科研市场为主,Illumina70%收入来源于科研服务,而30%来源于临床。相对临床市场,科研市场空间要小很多,因此随着厂家产品不断升级为更适合临床的产品,其应用市场将进一步打开,开启测序市场更大的空间。从国内市场来看,目前70%以上的测序仪依然来自于进口,国产的二代测序仪也大多是使用国外技术进行贴牌生产。
基于目前全球及国内测序仪市场竞争格局现状,笔者认为NGS测序仪市场竞争格局已经日趋稳定:Illumina、Thermo Fisher和华大三分天下,国产新秀如华因康、赛纳生物等后进入者很难与之竞争。
2020年全球基因测序仪及耗材市场分布及应用场景统计
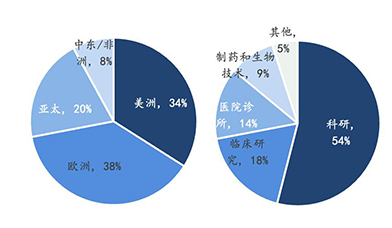
2020年全球及中国基因测序仪及耗材市场占比情况统计
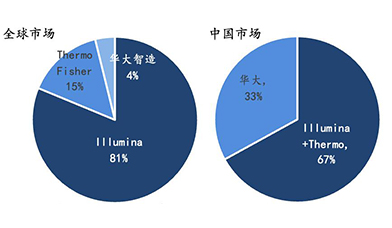
数据来源:华大智造招股书、BCC Researchs,万原点基金整理
根据美国国家卫生院数据,随着高通量测序技术的大规模使用,人类全基因组测序的成本实现了快速的降低,在2009年降低至10万美元左右,在2015年已降低至1,000美元左右。而目前,华大智造测序仪DNBSEQ-T7系列已经可实现测序成本降至约500美元。测序成本的日趋下降将推动基因测序在终端更高的应用渗透。人类全基因组测序成本历史变化趋势如下图所示:
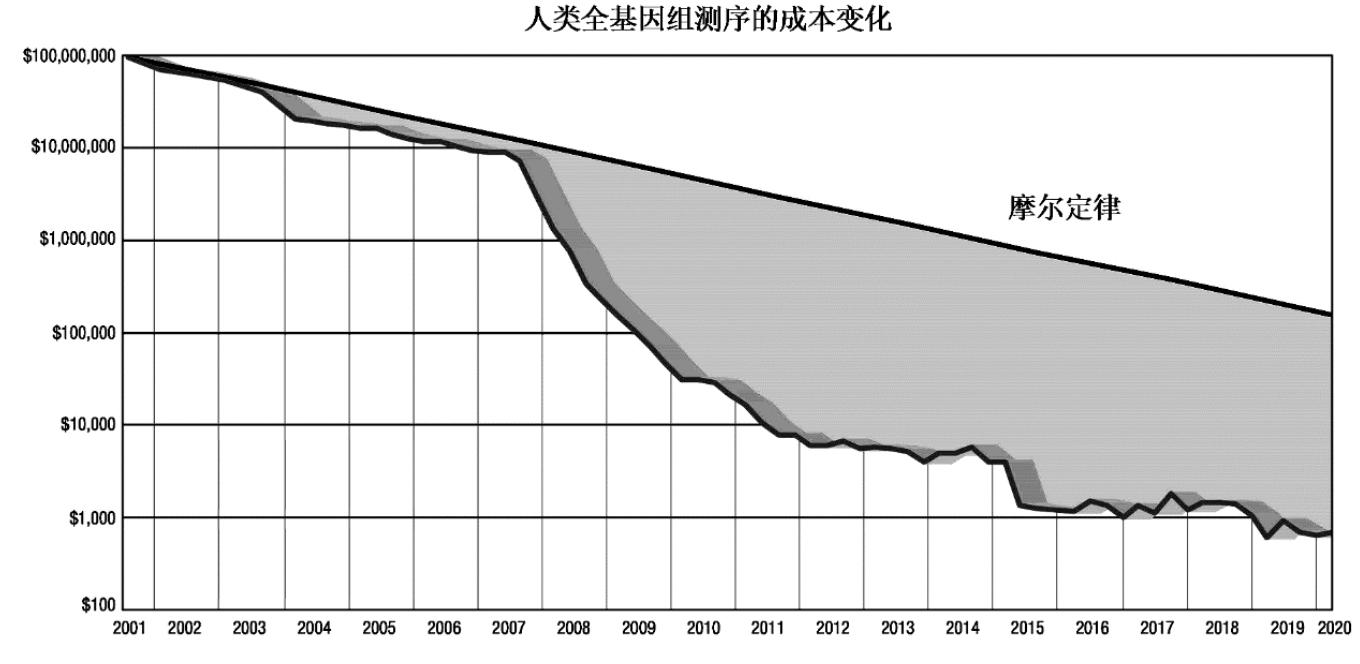
数据来源:美国国家卫生院
1.5 应用场景
目前科学研究仍是基因测序的主流应用场景,脱胎于科研而反哺科研。由于Sanger测序技术和NGS在全球科研机构中极高的接受度,2019年基因测序在科学研究板块的应用占据了全球基因测序市场超过一半的份额。此外,在测序行业前沿科学领域资金和投资项目的增加也反过来促进了些科研实体对DNA测序产品的需求,从而造就了更大的市场份额。
应用层面的市场份额占比也已超过1/3,商业应用落地持续发展推进。临床研究、医院诊所及生物医药公司这三个应用层面的终端使用客户在全球基因测序终端份额中的占比分别为16%、13%和9%,三者相加占到了38%的市场份额,超过了1/3。这也意味着测序技术在商业应用领域的落地也取得了相当的进展,随着测序技术的不断成熟完善、更多的使用场景被开发,预计这一趋势在未来将会持续上扬。
全球基因测序行业终端用户分布占比示意图
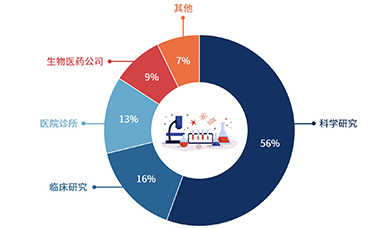
来源:Grand View Research,CB Insights中国,万原点基金整理
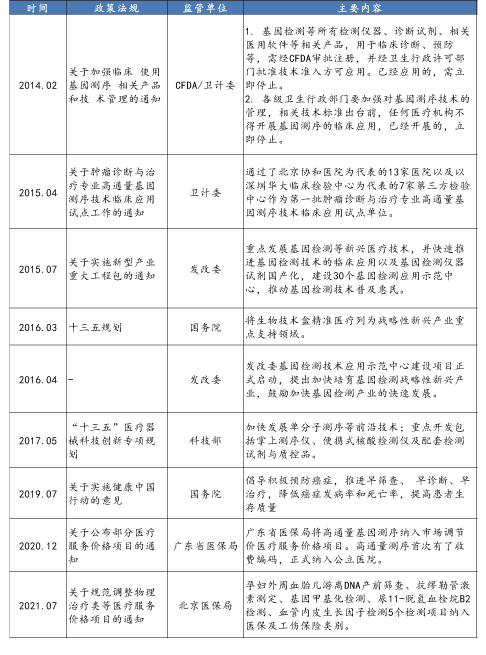
1.6 行业政策
基因测序发展的另一块基石,便是行业政策面的支持,促进行业向标准化和规范化发展,尤其是对于应用端消费级产品的标准化。政府和相关机构保持了多年的谨慎态度,在近年开始频吹暖风,支持行业健康规范有序地发展。
早期野蛮发展,监管趋严
早期基因测序行业在缺乏监管之下野蛮发展,导致行业乱象丛生。出于促进行业规范化的考虑,政府层面监管开始趋严。2013年11月,在个人DNA检测领域最负盛名的美国23 and Me公司推出的个人DNA检测服务被FDA叫停;2014年1月CFDA首先对基因测序的相关产品进行了分类界定,2月份突然叫停所有的基因检测项目和基因测序仪生产,基因测序行业突然失去方向停滞不前,进入了“冰河世纪”。
政策破冰,重归快轨
美国方面,顶层设计支持行业快速发展:美国对基因检测技术采用了有效兼顾监管和鼓励创新的LDT(实验室自制试剂)模式。在此模式下,只要是有CLIA(临床实验室改进修正案)执照的实验室,其研发的产品和技术服务就可以合法进入临床,合理收费。实验室取得CLIA标准相关认证后,检测结果即可用于指导临床诊疗。而对于面向个人的基因组测序公司,2015年2月,FDA批准了23 and me公司对布鲁姆综合征的主效基因进行检测。更为重要的是,美国总统奥巴马也在2015年国情咨文演讲中提出"精确医学计划",提议在2016财年向该计划投入2.15亿美元,推动个性化医疗发展。
双通路实现转化医学,CLIA模式独具匠心:在美国,基因测序产品如果转入临床应用,通常可以走两套审核程序:第一种是FDA 510K注册认证,主要负责审核医疗器械和试剂;另一种行业监管模式就是CLIA认证,在国内也叫参比实验室认证。CLIA认证是美国临床实验室委员会颁发的实验室资质证书,规定了临床诊断实验室操作的规范,实验结果的准确性、可靠性。通过该认证的实验室,就可以有资格使用二代测序技术对临床样本进行检测。该管理方式自实施以来,得到了患者、医院、第三方临检中心、保险公司的广泛认可,目前美国有近25万个CLIA实验室。CLIA实验室主要接受政府机构CMS(医疗保险和医疗补助服务中心)监管,FDA管理公司生产出来的产品,而CMS则管理实验室服务。如果没有CLIA实验室机制,新技术只有通过了FDA才能进入临床,美国四个提供无创产前诊断的公司,无一例外都是走的CLIA通路。总之,CLIA认证是解决了基础研究和临床应用之间低效率转化甚至脱节的一剂良方,对转化医学和研究成果 转化有非常重要的意义。
美国基因测序进入临床的两种通路示意图
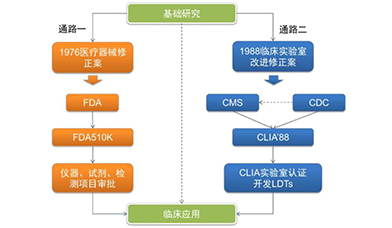
资料来源:FDA,万原点基金整理
国内方面,规范监管职责,公布试点名单,出台标准化指南:2014年2月国家卫健委、CFDA联合叫停基因检测,相关部门出台文件明确了基因测序行业的双重监管属性,所用的仪器设备归口CFDA报批管理,临床领域的使用归口卫健委或属地管理。3月份卫健委随即出台了《关于开展高通量基因测序技术临床应用试点单位申报工作的通知》,拉开了基因测序行业临床应用规范化的大幕。随后,从2014年6月到2015年3月不到一年时间,NMPA先后批准华大基因、达安基因等公司的测序仪和测序产品,卫健委先后正式授牌"个体化医学检测试点单位"(3家),确定首批高通量测序技术临床应用试点单位(7家),其中包括5家第三方医学检验所华大、达安、博奥、安诺优达和爱普益,同时陆续公布了临床应用首批四大领域:遗传病诊断、产前筛查与诊断、植入前胚胎遗传学诊断、肿瘤诊断与治疗。从中可以看到,我国NGS临床试点制度的推行参考的正是美国CLIA认证制度,即要求试点单位内部有严格的质量控制,并且相关工作人员需经培训合格上岗,则不受NMPA对仪器和试剂的注册限制。
中国基因测序暂行准入机制示意图
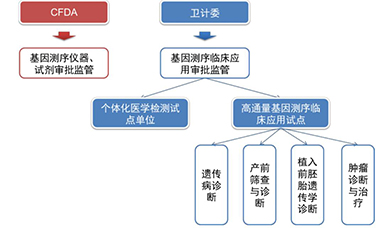
资料来源:卫健委,NMPA,万原点基金整理
到2015年7月,国家发改委发布《关于实施新兴产业重大工程包的通知》,将在2015至2017年建设30个基因检测技术应用示范中心,以开展遗传病和出生缺陷基因筛查为重点,推动基因检测技术普及和产业化。同时卫健委医政医管局出台的《药物代谢酶和药物作用靶点基因检测技术指南(试行)》和《肿瘤个体化治疗检测技术指南(试行)》文件,则有效解决了药物基因组学和肿瘤个性化治疗的行业标准缺失的问题。
总体而言,监管的明确、试点单位的公布、肿瘤个体化用药等应用端标准的出台, 预示着行业的政策严冬过去,行业准入标准提高,以生育健康检测、肿瘤个性化治疗为代表的基因产业下游行业标准框定之后,整个基因测序产业有望重回高速发展的轨道上。
国内基因测序行业政策梳理
资料来源:公开信息,万原点基金整理
1.7 投融资梳理
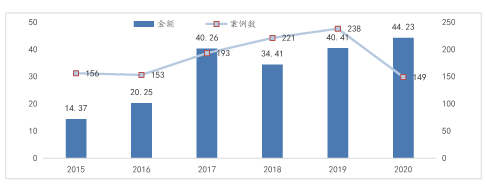
巨量资本的注入给整个基因测序行业的发展带来了强大的推动力。自2015年以来,面向基因测序初创公司的全球融资经历了快速、持续的增长。在过去的6年中,全球资本对初创基因测序公司的投资资金增长迅猛,2020年的投资金额相比于2015年增长了3倍。
受疫情影响,全球基因测序领域公司的融资交易数量有所下降,但在创纪录的大轮融资中资金依然保持强劲。从2015年到2020年,基因测序领域公司每年获得的资金增长了6倍多。在随后的2017年、2018年里虽然交易数量持续增加,但总融资自此稳定在每年40亿美元左右。尽管2020年的融资总额有望超过2019年,但2020年迄今为止(YTD)的数据表明,投资成交量正在放缓,预计将降至2016年的水平。
2015-2020年全球基因测序行业融资统计(亿美元)
资料来源:亿欧数据,万原点基金整理
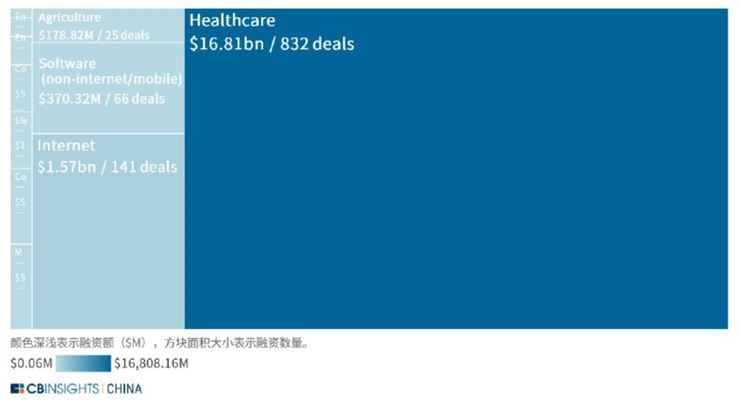
2015年1月至2020年10月全球基因测序行业主要应用领域的最大融资数量统计
资料来源:CB Insights中国,万原点基金整理
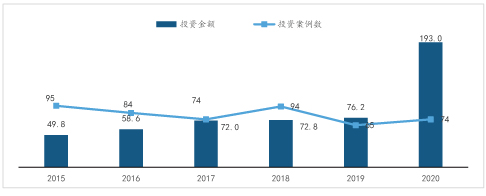
新冠疫情大大推动了我国基因检测行业的快速发展。2020年,我国基因测序行业融资金额创新高,全年达到193亿元,同比增长2.5倍。投资案例数同比略有上升,说明平均单笔融资规模大幅提升。
2015-2020年中国基因测序行业融资统计(亿元)
资料来源:wind,万原点基金整理
投资者变得更为青睐头部成熟后期公司。根据CB Insights中国的数据,近五年来基因测序领域种子轮和天使轮的融资交易的占比总体呈下降趋势,已经从2016年的44%下降到2019年的27%,再加上2020年预计的总交易数量可能由2019年的238笔下降至2020年预计的149笔,以及超大规模单轮融资的增加,表明投资者正在将资金集中在更成熟的后期公司的更大交易上。
2015-2019年全球基因测序行业融资轮次统计
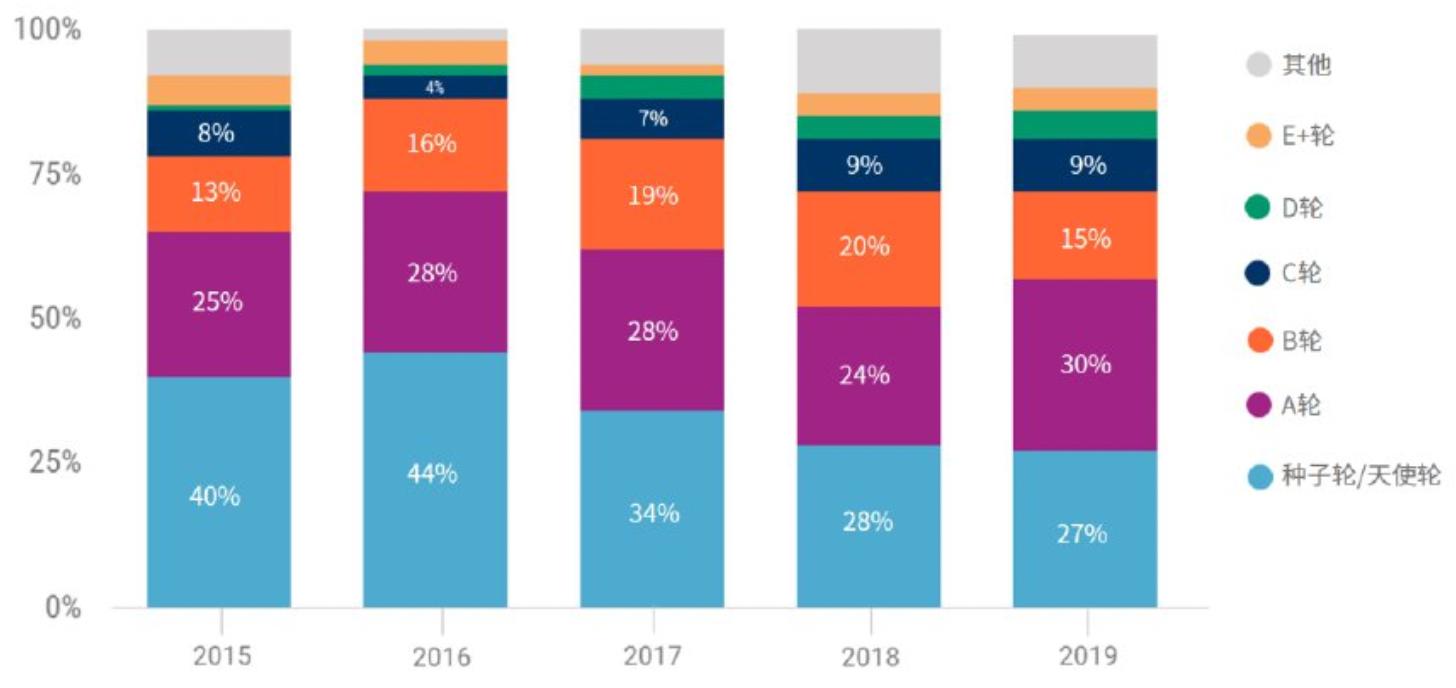
资料来源:CB Insights中国,万原点基金整理
从2015年至2020年的基因测序领域公司IPO或并购退出前的融资总额的走势来看,前四年维持相对平稳的状态,而在2020年这一数值几乎是往年平均总额的三倍,并购退出前融资总额达到了惊人的23.7亿美元。
基因测序领域公司IPO或M&A退出前融资总额统计
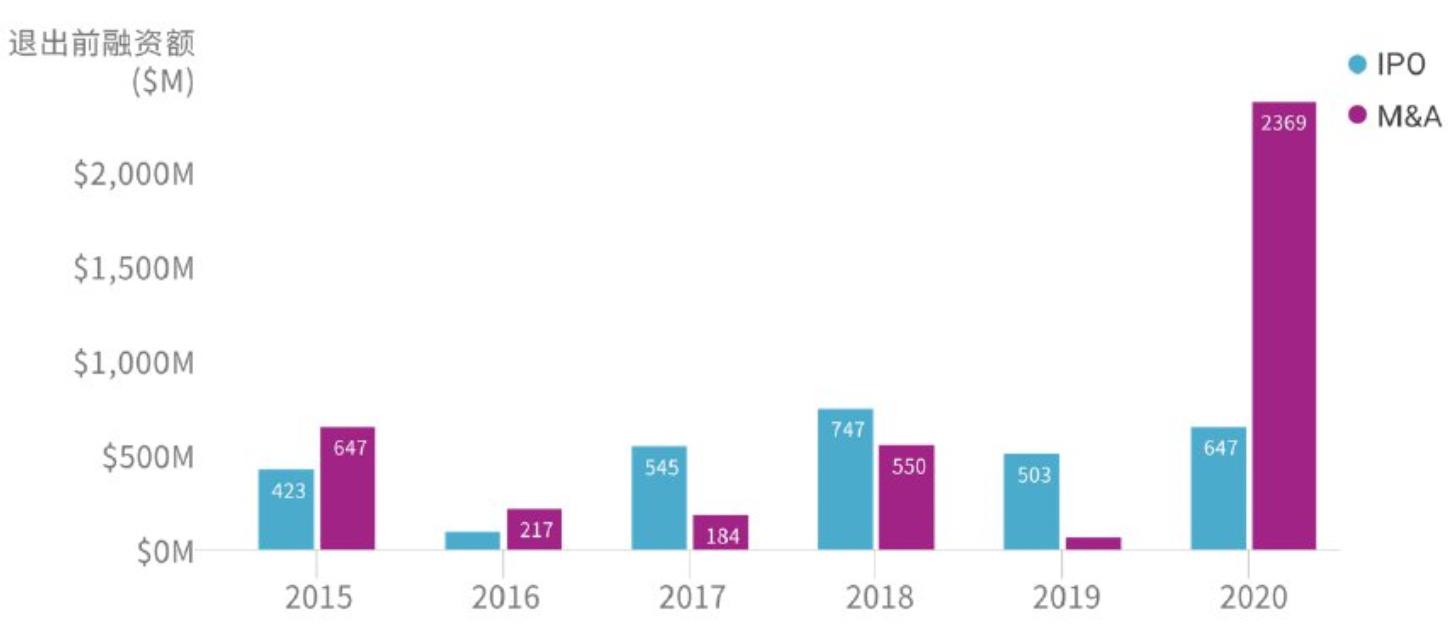
资料来源:CB Insights中国,万原点基金整理
国内近年来基因测序行业融资事件梳理
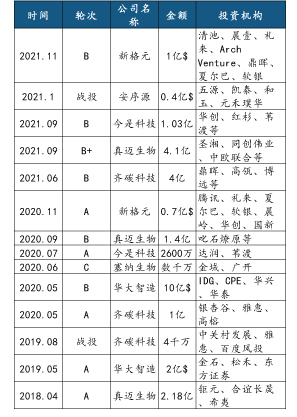
2 纳米孔测序
将如NGS这样的短读长测序技术更广泛地应用在结构变异检测和基因组组装中时,它的缺点就开始逐步显现:基因读取长度有限。短读长测序仪读取长度为600个碱基,这就意味着有超过70%的人类基因组结构变异(即影响序列长于50bp的变异)无法在NGS平台上被检测到。此外,人类超过15%的基因组仍然无法实现装配或发现变异,因为这些基因组上有着重复序列或非典型的GC含量。例如,当某段基因的GC含量超过45%时,即使没有经过PCR扩增,短读基因组文库的序列覆盖率也会下降两倍,这极大的限制了对基因组中一些最重要的功能区域进行研究从而发现遗传变异的机会。
基因组中这些难以探测的、大量的串联重复序列占主导的区域包括着丝粒、端粒和顶体基因组,并且更值得关注的是,这些区域不管是在生殖细胞还是体细胞中都有着最高的突变率。然而这些最易变的区域在此前并未能被充分研究,这些NGS现有的局限性也使得开发能够检测基因组中这些更复杂和动态区域的方法变得更有必要且更为急迫。
2.1 基本介绍
纳米孔测序技术是最近几年兴起的新一代测序技术,目前测序长度可以达到150kb。纳米孔分析技术起源于Coulter计数器的发明以及单通道电流的记录技术。生理与医学诺贝尔奖获得者Neher和Sakamann在1976年利用膜片钳技术测量膜电势,研究膜蛋白及离子通道,推动了纳米孔测序技术的实际应用进程。1996年,Kasianowicz等提出了利用α-溶血素对DNA测序的新设想,是生物纳米孔单分子测序的里程碑标志。随后,MspA孔蛋白、噬菌体Phi29连接器等生物纳米孔的研究报道,丰富了纳米孔分析技术的研究。Li等在2001年开启了固态纳米孔研究的新时代。
测序原理:在充满电解液的腔内,带有纳米级小孔的绝缘防渗膜将腔体分成2个小室,如图1,当电压作用于电解液室,离子或其他小分子物质可穿过小孔,形成稳定的可检测的离子电流。掌握纳米孔的尺寸和表面特性、施加的电压及溶液条件,可检测不同类型的生物分子。由于组成DNA的四种碱基腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)和胸腺嘧啶(T)的分子结构及体积大小均不同,单链DNA(ssDNA)在核酸外切酶的作用下被迅速逐一成脱氧核糖核苷酸分子,当单个碱基在电场驱使下通过纳米级的小孔时,不同碱基的化学性质差异导致穿越纳米孔时引起的电流的变化幅度不同,从而得到所测DNA的序列信息。
纳米孔测序原理示意图
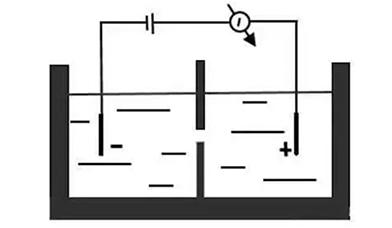 资料来源:公开信息,万原点基金整理
资料来源:公开信息,万原点基金整理
2.2 主流测序平台
目前用于DNA测序的纳米孔有两类:生物纳米孔(由某种蛋白质分子镶嵌在磷脂膜上组成)和固态纳米孔(包括各种硅基材料、SiNx、碳纳米管、石墨烯、玻璃纳米管等)。DNA链的直径非常小(双链DNA直径约为2nm,单链DNA直径约为1nm),对所采用的纳米孔的尺寸要求较苛刻。
生物纳米孔路线:天然的生物纳米器件,具有特定的孔径结构、生物活性及能够插入脂双分子层膜的能力,由于其可进行灵活的化学或生物修饰而受到科学家的青睐。最先成熟和商业化运营。代表公司为Oxford Nanopore Technologies(ONT)。
固态纳米孔路线:主要是在氮化硅、二氧化硅和石墨烯等绝缘材料上用离子刻蚀技术、 电子刻蚀技术、聚焦电子束(FEB)或离子束(FIB)等制作出的微小孔洞。
目前固态纳米孔的制备,首先用常规微加工技术制作30~500nm厚的悬空薄膜,再用离子束或电子束等在硅或其他材料薄膜表面钻出2~100nm的孔洞。DNA检测中所需的纳米孔直径都是1~2nm,可在前述操作的基础上,进一步采用沉淀物质收缩、离子束辐射、电子束辐射等收缩技术减小纳米孔的尺寸,从而达到更小目标尺寸的纳米孔。哈佛大学Li等在2001年首次报道了使用离子刻蚀技术在Si3N4薄膜上制作出了直径61nm的孔,同时利用氩离子束辐射使纳米孔收缩到1.8nm,开启了固态纳米孔制备和研究的新时代。固态纳米孔具有稳定耐用的特点,其制造技术日益成熟,丰富了纳米孔单分子检测技术研究。需要说明的是,截至目前,全局范围内固态纳米孔鉴于纳米孔加工工艺的限制,该技术路线尚处于科研层面,尚未有稳定加工并实现量产的1-2nm级别的固态孔测序产品问世。
2.2.1 牛津纳米孔技术
公司简介:公司成立于2005年,依托牛津大学Hagan Bayley教授的科学理论,致力于开发基于纳米孔技术的突破性、单分子、电子传感系统。公司的首例产品MinION于2014年推出,进入客户早期试用阶段,并于2015年开始销售。之后,更高通量的GridION和PromethION于2017年面世。公司拥有丰富的研发产品线,其中包括可与手机兼容的SmidgION测序仪。公司曾经获得包括腾讯、新加坡主权财富基金、阿布扎比科技中心、施罗德、Odey Asset Management和Lansdowne等知名机构的投资,并于2021年12月在伦敦交易所IPO上市,上市当日市值达67亿美元。2020年营收1.139亿欧元,其中生命科学研究工具业务收入为6550万欧元,COVID-19测试收入为4830万欧元。公司仍然处于亏损状态,2021年上半年的亏损为4480万英镑(6200万美元)。
专利纷争:2014年ONT公司推出第一款商业化纳米孔测序仪MinION。2016年2月23日,Illumina起诉ONT公司的纳米孔测序技术侵犯了其两项专利(No. 8,673,550和No.9,170,230,专利名称均为“MspA纳米孔和相关方法”),同时Illumina还向美国国际贸易委员会和美国南加州地方法院提交了此项诉讼。3月8日,ONT公司宣布升级版测序仪R9将使用自主知识产权的孔蛋白CsgG,该孔蛋白由比利时弗兰德斯生物技术研究所分子生物学家Han Remaut引领的研究团队于2014年发布CsgG(大肠杆菌蛋白)的结构,ONT公司对该孔隙持有独家专利。至此,ONT与Illumina专利权战告一段落。
MspA孔蛋白:耻垢分枝杆菌中的孔蛋白(Mecobacterium smegmatis porinA,MspA)是适合用于DNA测序的另一个纳米孔蛋白。MspA呈圆锥状,是八聚体孔蛋白,有一个宽约1.2nm,长约0.6nm的短窄收缩区。与5nm长的αHL蛋白孔相比,MspA更有利于对单碱基的测定。将核酸末端连接核酸分子夹,利用MspA纳米孔识别四个单碱基的技术,可减缓DNA的穿越速度,提高DNA单碱基检测的灵敏度。
2010年,华盛顿大学的Jens Gundlach首次证明MspA可应用于DNA测序,与阿拉巴马大学的微生物学家Michael Niederweis 合作证明MspA孔隙结合“棘轮系统”(ratcheting system)便可读取短DNA序列,并申请专利。2013年10月,美国阿拉巴马大学和华盛顿大学宣布授权Illumina使用其MspA蛋白专利。
MspA纳米孔蛋白示意图
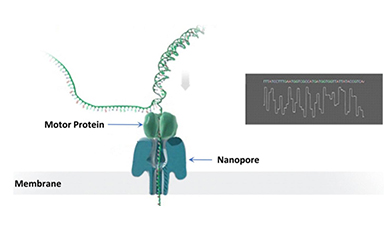
测序原理:纳米孔测序技术的核心是一种整合了多个跨膜通道蛋白(即纳米孔蛋白)的多聚物膜。由于纳米孔的直径非常细小,通常仅可以让单个碱基通过。通过在膜两侧施加电压从而产生稳定的穿过纳米孔的电流,当有其他物体穿过纳米孔时,会影响电流的大小,从而产生可识别的电信号的变化。测序时,DNA双链在马达蛋白(马达蛋白)的牵引下解螺旋为单链 DNA,并穿过纳米孔蛋白(也叫Reader蛋白)。由于ATCG四种碱基结构和大小的差异,会使电流产生特征性离子电流变化,通过识别这种电信号的变化,从而达到读取碱基序列的目的。
ONT纳米孔测序原理示意图
技术优点:
(1)长读长:由于ONT测序依赖于核酸易位的物理过程,所以该方法在测序读长上则更具有优势,2018年报道数据中其测序读长达到2.27MB(最新更新的数据为4.2MB)。核酸提取是长读长的关键步骤,目前已经有许多较为成熟长片段DNA提取试剂盒,包括旋转柱(如 Monarch 基因组DNA纯化试剂盒)、重力流柱(如NucleoBond®HMW DNA试剂盒)、磁珠(如 MagAttract HMW DNA 试剂盒)。此外,由于小片段DNA分子具有更快的过孔速率和更高的接头连接效率的特性,在长片段DNA提取时,去除小片段DNA分子对于得到高产出数据量至关重要。针对此问题,目前也有较多成熟方案,如Sage Science的基于凝胶的BluePippin系统、磁珠和Circulomics的Short Read Eliminator kit等。
(2)通量高:为满足不同客户、不同应用场景的不同数据量需求,ONT发布了多个平台。Flow cell的预期数据产出主要影响因素包括:活性纳米孔的数量、通过纳米孔的核酸易位速度和持续运行时间。早期使用MinION的用户每个flow cell仅能产出几百兆(MB)数据,而目前该数值增长到10-15GB。测序速度也从之前的30 bp/s增加到了如今的450 bp/s,且兼顾了更长的运行时间。升级款PromethION可运行更多的flow cell,每个flow cell具有更多的纳米孔,单张PromethION flow cell的数据产出量为153GB。
(3)RNA直接测序:ONT可以对天然RNA分子直接进行测序,因此保留了RNA上的表观修饰信息(如m6A)。但该方法需要特殊的文库制备:先将引物连接到天然RNA分子的3′端,然后在无需反转录的情况下直接连接接头。此外,也可以合成cDNA链以获得RNA-cDNA杂交双链,然后连接接头。前者由于其速度极快更适合于紧急状况下的应用(如新冠病毒基因组),而后者为更长的测序过程生成更稳定的库,因此可以得到更高的数据产量。与DNA测序相比,RNA直接测序的平均准确率较低(约83–86%)。与常规RNA测序一样,ONT 可用于利用现有全长cDNA合成方法进行cDNA测序,然后进行PCR扩增。与许多现有的cDNA测序方法相比,ONT还提供了一种无需PCR扩增的直接cDNA测序方案,避免了PCR扩增偏差。
技术缺点:
(1)无法直接检测单碱基信号:受限于生物孔结构的原因,ONT直接测序路线一次检测3个碱基的信号,通过算法实现单碱基信号的读取。该测序方法存在一定的准确度天花板;
(2)单芯片通量提升空间有限:ONT测序路线的技术原理表明其只能直流供电,功耗原因导致单张芯片测序单元的密度无法更进一步的得到提升,导致单张芯片测序通量提升空间有限。
(3)测序成本高:ONT目前单张芯片测序单元3000个,一直尚未有更高密度的芯片发布,目前扩展测序通量的方式是多张芯片并联运行,测序成本压缩空间有限。
2.2.2 吉尼亚科技
公司简介:Genia Technologies创办于2009年,专注于纳米孔测序技术的研发。公司是通过与哥伦比亚大学Jingyue Ju教授和哈佛大学的George Church教授团队合作开发此单分子测序平台,获得了Jingyue Ju教授和美国国家标准与技术研究所(NIST)John Kasianowicz团队开发的纳米孔合成测序技术的独家许可(称为Nano-SBS或NanoTag测序),并计划将其与其纳米孔芯片平台整合,并使用哈佛大学开发的聚合酶融合蛋白。哥伦比亚的Jingyue Ju和NIST的John Kasianowicz的团队在2013年发布了NanoTag测序的概念验证,与蛋白质纳米孔偶联的聚合酶将标记的核苷酸合并到DNA模板中,每种类型的核苷酸都带有不同大小的标签。公司已于2014年被Roche亿3.5亿美元的对价收购,目前尚未有产品发布。
在被收购前,Genia计划在2013年底前向测试版客户发货,计划在2014年将商业产品推向市场。然而在收购以后的几年,罗氏并没有把Genia的测序仪推向市场,原因是在收购之后罗氏“重新审视了他们认为将测序仪推向临床测序市场所需的规格”,而罗氏的要求“比Genia之前设定的推出可行产品的目标要严格得多”。
测序原理:Genia测序路线简单可以类比为PacBio和ONT的有机结合,是将纳米孔检测和被广泛采用的边合成边测序的体系结合起来,在对核酸进行检测的时候,并不依赖于待测核酸链与纳米孔直接相互作用给出碱基特异阻断电流来进行测序,而是利用聚合酶对待测核酸链进行复制。用于复制的核苷酸经过特殊修饰,与纳米孔相互作用时可以给出识别度极高的特征阻断电流。系统通过对这些特征阻断电流的实时监控来识别复制过程参与每一步生化反应的核苷酸种类,从而获得待测核酸的序列信息。
Genia纳米孔测序原理示意图
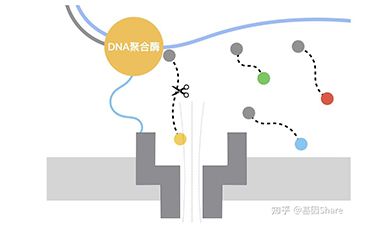
资料来源:Genia专利,万原点基金整理
Genia纳米孔蛋白采用的是专利已过期的α-溶血素(αHL)孔蛋白。
α-溶血素(αHL)纳米孔:αHL是目前最广泛使用的生物纳米孔的分析物质,由293个氨基酸多肽构成,可插入到纯净的双分子层脂膜中形成蘑菇状七聚体,组装成跨膜通道。αHL七聚体纳米孔主要由帽型区(Cap,入口cis端直径为2.6nm)、边缘区(Rim,直径为1.4nm)和主干区 (Stem,入口trans端直径为2.2nm)三部分构成。αHL 纳米孔永久开通不关闭,耐强酸和强碱,高温、高电压下较稳定。1996年,Branton小组第一次演示当电流驱使单链DNA穿过镶嵌在磷脂双分子层上的α-溶血素蛋白时会使电流瞬时下降,证明纳米孔蛋白可以用于DNA的检测。随后Kasianowicz等采用α-溶血素蛋白纳米孔对单链DNA、单链RNA易位行为进行研究,提出利用α-溶血素纳米孔实现快速、廉价的DNA测序的设想,是生物纳米孔单分子检测研究的里程碑标志。
英国牛津大学Bayley教授将α-溶血素与核酸酶结合后,利用氨基化环糊精配体固定,将待测核酸上的碱基按顺序剪切后在电场的作用下有序地通过蛋白质纳米孔,使其可以选择性识别四种碱基。英国牛津纳米孔技术公司 (Oxford Nanopore Technologies)成功将该研究成果用于核酸测序。需要说明的是,α-溶血素(αHL)纳米孔目前专利已过期。
α-溶血素纳米孔蛋白示意图
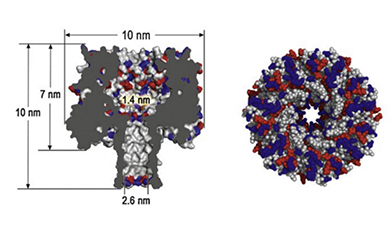
技术优点:
(1)可以实现单碱基信号的读取:ONT测序路线受限于生物孔结构的问题,无法实现单碱基信号的读取,必须通过算法才能获得单碱基信号,测序准确度存在一定的天花板。Genia测序路线可以直接读取单碱基信号,理论上测序准确度提升空间更大;
(2)交流供电,芯片测序单元大幅提升:ONT测序路线决定了其只能用直流供电,功耗原因导致单张测序芯片测序单元密度提升空间有限。Genia测序路线使用超级电容电极供电,测序单元高度微型化,芯片集成度高,理论上单张芯片测序通量提升空间更大。
(3)单张芯片通量更高带来的成本优势:Genia测序路线由于测序芯片的测序单元密度更高,因此单张芯片理论上的测序通量更高,高通量会带来一定的成本优势。
技术缺点:
(1)合成失败导致的错误率:该技术路线采用边合成边测序技术路线,存在一定的碱基合成失败的几率,从而影响整体的测序准确度。
(2)技术路线能否走通存在一定的不确定性:罗氏2014年收购至今已7年,一直未有产品发布,不确定该技术路线是否最终能走通。
2.2.3 Stratos基因组学
公司简介:公司成立于2007年,是一家专注于扩展测序(Sequenceing by Expansion,SBX)的早期阶段的测序技术公司。公司于2014年获得罗氏1500万美元的B轮投资,2020年被罗氏收购。
测序原理:SBX测序技术的核心是一种叫X-NTPs的新核苷酸,和普通dNTPs相比,X-NTPs在碱基环和五碳糖连接的磷酸基团之间,加入了一个loop,该loop可以分别标记ATCG四种不同的核苷酸,并且可以放大通过孔时产生的信号,同时在五碳糖和相邻的磷酸基团之间有一个可切割的linker。
DNA复制时,特殊的DNA复制酶以X-NTP为底物,根据模板DNA的序列,依次将ATCG四种不同的X-NTP连到3'端,复制出来的DNA链叫Xpandomer。DNA复制完成后,用特殊的酶在cleavable linker处切断,切断linker后Xpandomer上的loop可以展开,形成一条线性的分子,长度是原来DNA长度的50倍,这条展开的线性Xpandomer就可以上机测序。
需要说明的是,Stratos测序平台采用的是固态纳米孔路线,由于检测过孔的Xpandomer链上特异片段的过孔电信号,不需要纳米孔尺寸控制在1.2nm,因此更容易实现。
Stratos测序原理示意图
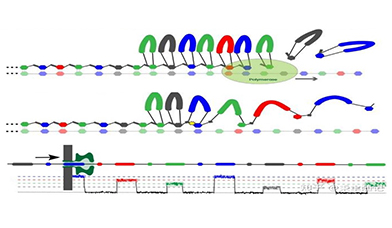 资料来源:Stratos官网,万原点整理
资料来源:Stratos官网,万原点整理
技术优点:
(1)单碱基信号读取:SBX测序技术通过合成Xpandomer,使原来碱基间距扩大50倍,从而在过孔时实现单碱基信号的读取。
(2)纳米孔尺寸更容易加工:该技术路线由于检测的Xpandomer远大于碱基,无需1-2nm的纳米孔尺寸要求,现有的加工精度更容易实现。
(3)成本优势:该测序路线采用固态孔测序路线,固态孔和生物孔相比存在一定的成本优势。
技术缺点:
(1)短读长:由于Stratos测序平台需要人工合成Xpandomer,目前最长222bp。
2.3 市场规模
根据Straits Research的数据,2019年长读长测序市场规模估计为9.74亿美元,预计在2020年到2029年之间将会以24%的年复合增长率增长。市场规模的预期增长可以归因于长读长测序技术包括SMRT和纳米孔测序技术的快速进步以及顺利的商业化落地进程。
2017-2029年全球长读长测序市场规模增长趋势预测
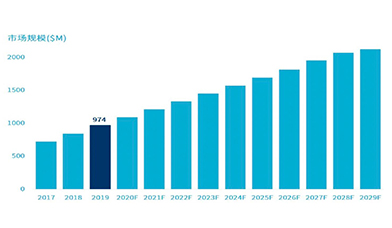
资料来源:Markets and Markets,万原点基金整理
遗传性和代谢性疾病筛查为主要增长动力之一。全球范围内遗传性疾病的日益增多使基因组学领域的研发支出激增。根据WHO的资料,镰状细胞贫血是一种严重的遗传性疾病,每年超过72000名新生婴儿患有此病;在英国每年超过6000人诊断出遗传性血友病。随着基因治疗的发展和人们对产前诊断意识的不断提高,新生儿筛查的普及率在不断提高、改善患者生活质量的意愿在不断加强,这些因素一并为市场增长提供了动力。
对人类基因组的科研活动的巨额投资也在催化市场增长。根据Battelle的数据,从2009年到2014年间亚洲地区在基因组测序领域的研发投资增加了7%。此外,全球测序行业巨头也在开展广泛的研究,以开发更为创新的长读长测序技术,从而获得竞争优势,MinION、GridION、PromethION、PacBio RS System、Sequel System 等测序仪器推陈出新,广泛应用于人类基因组学、癌症、表观遗传学、转录组分析中的基因测序过程,进一步推动了该领域的发展。
2017-2029年中国长读长测序市场规模增长趋势预测
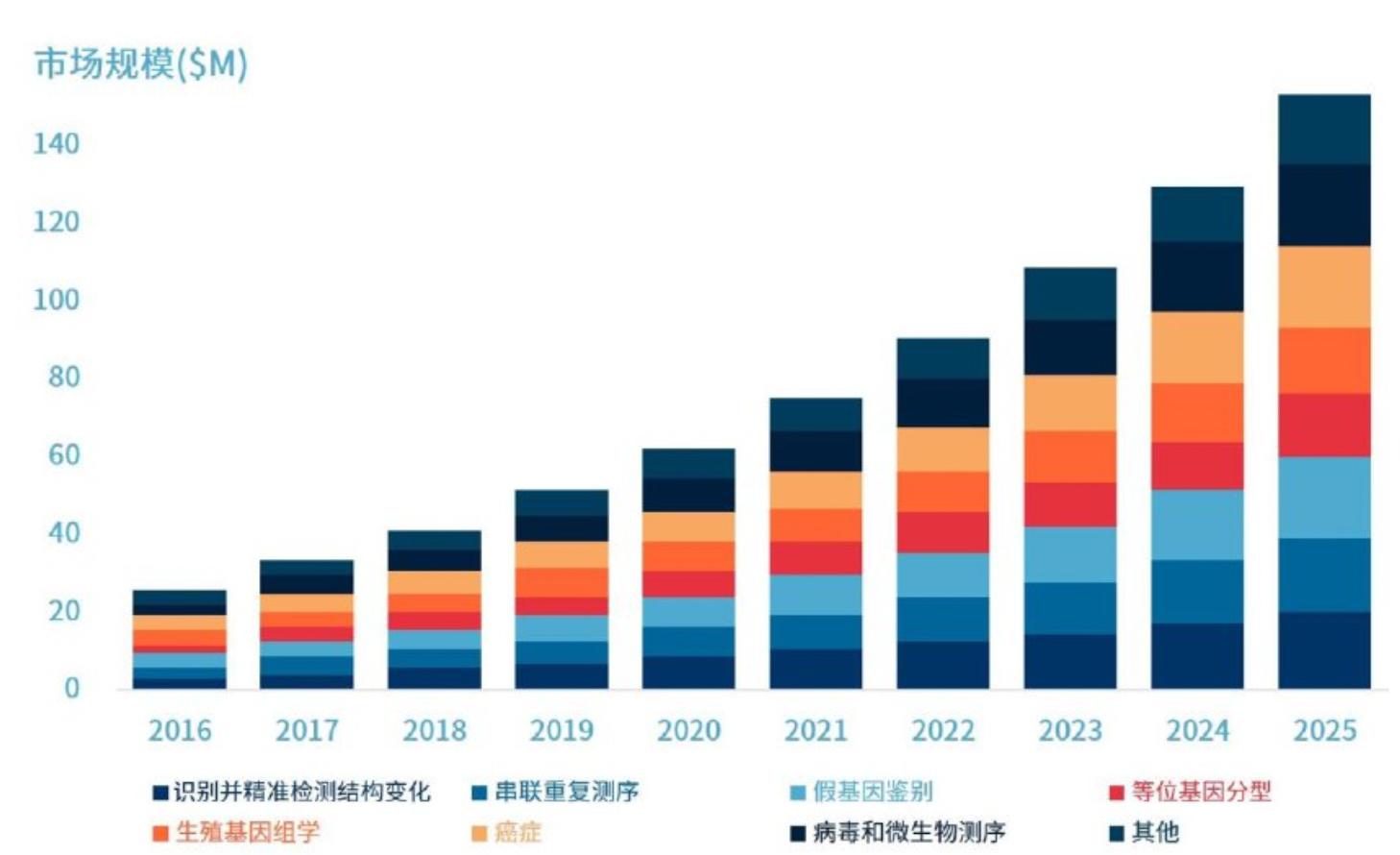
资料来源:海峡研究,万原点基金整理
2.4 竞争格局
目前全球长读长测序平台已经商业化运作的只有Pacbio的SMRT测序平台和ONT的纳米孔测序平台。目前无论是PacBio还是ONT,虽然测序读长得到了大幅提升,但是准确度和NGS相比还偏低(~90%),且测序成本偏高。市场装机量还比较少,目前更多是科研市场的少量应用。
已商业化长读长测序平台性能参数梳理